Transcription mediated amplification
Transcription-mediated Amplification (TMA; deutsch auch: transkriptionsvermittelte Amplifikation oder transkription-vermittelte Verstärkungsreaktion) ist eine molekularbiologische Technik zur Bestimmung des Vorhandenseins bestimmter Erbgutsequenzen in einem Material. Amplifikation bedeutet hier die Herstellung vieler Kopien einer in geringer Menge vorhandenen Nukleinsäuresequenz, um sie detektieren zu können. Für die Amplifikation der gesuchten Sequenz (Zielsequenz) werden zwei Enzyme verwendet, die RNA-Polymerase und die Reverse Transkriptase. Die Nutzung dieser zwei Enzyme erklärt die Verwendung des Worts "transkriptionsvermittelt", denn diese Enzyme werden in der Zelle für die Erbgut-Transkription verwendet. Die Technik kann angewandt werden, um sowohl RNS- als auch DNS-Zielsequenzen zu finden. Das Ergebnis der Reaktion ist immer ein RNS-Amplicon. Jedes der neu synthetisierten RNS-Amplicone geht erneut in TMA-Prozess ein und dient damit als Vorlage für eine neue Runde der Replikation, was zu einer exponentiellen Expansion des Ziel-RNS-Amplicons bei der Reaktion führt. Die Reaktion läuft autokatalytisch ab. Nach der Vermehrung der Zielsequenzen werden diese mit einer Oligonukleotidsonde hybridisiert, die ihrerseits chemilumineszent ist. Das Vorhandensein der Zielsequenz wird am Ende also photometrisch, sozusagen durch ein Leuchtsignal des Reaktionsprodukts, festgestellt.
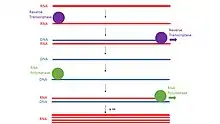
Die TMA hat gegenüber der Standardmethode, der Polymerase-Kettenreaktion (PCR), folgende Vorteile: Die Methode benötigt weniger Arbeitsschritte. Die Reaktion benötigt keine Temperaturzyklen, wie die PCR sie benötigt. Statt in einem Thermocycler wird sie in einem Wasserbad oder einem Thermoblock bei etwa 41 °C durchgeführt. Die TMA ist schneller als die PCR, bei der sich die Zahl der Kopien in jedem Zyklus maximal verdoppelt. Die TMA kann zwischen 100 und 1000 Kopien pro Zyklus erzeugen und so innerhalb von 15–30 Minuten eine bis zu 10-Milliarden-fache Erhöhung der Anzahl der Zielsequenzen erzeugen. Zudem kann die TMA eingesetzt werden, um mehrere bzw. viele verschiedene Zielsequenzen gleichzeitig zu suchen. Das Reaktionsprodukt, die RNA, ist außerhalb des Reaktionsgefäßes instabiler als PCR-Produkte, was dazu führt, dass Kreuzkontaminationen bei dem Verfahren seltener sind.
Die Methode wurde erstmals 1995 von Kacian und Fultz wissenschaftlich beschrieben und im selben Jahr patentiert (US-Patent: US5399491A).
Bedeutung in der medizinischen Diagnostik
Die Methode steht für eine Vielzahl von Pathogenen zur Verfügung (u. a. Chlamydia trachomatis, Neisseria gonorrhoeae, Hepatitis B, Hepatitis C, HIV-1-RNA, Zika-Virus, Enterokokken, Listerien, Salmonellen, Campylobacter spp.). Die TMA hat zuletzt besondere Bedeutung in der schnellen SARS-CoV-2-Analytik erlangt, wofür sie seit Ende 2020 zur Verfügung steht, da hier ein hoher Bedarf für rasche Analyseergebnisse besteht. Sie ist in dieser Hinsicht der seit Ende 2019 zur Verfügung stehenden PCR überlegen. Bei der SARS-CoV-2-TMA werden typischerweise zwei Zielsequenzen in der 1ab-Region (ORF1ab) der Virus-RNA amplifiziert.
Literatur
- Daniel L. Kacian, Timothy J. Fultz: Nucleic acid sequence amplification methods. In: Biotechnology Advances 1995, 13.3, S. 569–569
- Patentanmeldung US5399491A: Nucleic acid sequence amplification methods. Angemeldet am 19. März 1992, veröffentlicht am 21. März 1995, Anmelder: Gen Probe Inc., Erfinder: Daniel L. Kacian, Timothy L. Fultz.