Tetrazepam
Tetrazepam ist ein Arzneistoff aus der Gruppe der Benzodiazepine mit muskelrelaxierender, angstdämpfender und sedierender Wirkung. Tetrazepam ist bei schmerzreflektorischer Muskelverspannung angezeigt, insbesondere als Folge von Erkrankungen der Wirbelsäule und der achsennahen Gelenke und bei spastischen Syndromen, die auf eine krankhaft gesteigerte Muskelspannung zurückzuführen sind. Ein zweites Anwendungsfeld sind Angststörungen und Panikattacken.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
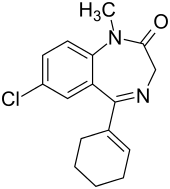 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Tetrazepam | |||||||||||||||||||||
| Andere Namen |
7-Chlor-5-(cyclohex-1-enyl)-1-methyl-1,3-dihydro-2H-1,4-benzodiazepin-2-on (IUPAC) | |||||||||||||||||||||
| Summenformel | C16H17ClN2O | |||||||||||||||||||||
| Kurzbeschreibung |
gelbbraune Kristalle[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
M03BX07 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 288,77 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
schlecht in Wasser: 26,4 mg·l−1 (bei 25 °C)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Tetrazepam darf wegen seines ungünstigen Nutzen-Risiko-Profils nicht mehr vermarktet werden. Es war nur in wenigen europäischen Ländern, unter anderen in Deutschland und Österreich, eingeführt worden.
Pharmakologie
Anwendungsgebiete
Tetrazepam wird als Muskelrelaxans bei schmerzreflektorischer Muskelverspannung und bei spastischen Syndromen angewendet, die auf eine krankhaft gesteigerte Muskelspannung zurückzuführen sind, sowie bei neurogenen Kontrakturen und Muskelhypertonus.
Pharmakokinetik
Die Bioverfügbarkeit beträgt 90–100 %, maximale Plasmakonzentrationen werden nach 1,5–2 Stunden erreicht, Plasmaproteinbindung ca. 70 %, Plasmahalbwertszeit 12–18 Stunden, Steady-state-Konzentrationen nach circa drei Tagen, die Elimination erfolgt nach hepatischem Metabolismus in Glukuronide überwiegend renal, Äquivalenzdosis (= 10 mg Diazepam) 50 mg.[4]
Wirkmechanismus
Die durch GABA vermittelte synaptische Hemmung wird gefördert (freigesetzte GABA wirkt effektiver), vermehrter Cl-Einstrom, Reduktion der Erregbarkeit der Neuronenmembran, Hemmung der mono- und polysynaptischen Reflexbögen, Dämpfung des Muskeltonus, zusätzlich spannungs-, erregungs-, angstdämpfende, sedierende, hypnotische und antikonvulsive Effekte.
Nebenwirkungen
Als charakteristische Nebenwirkungen von Tetrazepam können Müdigkeit, verlangsamte Reaktionen, Halluzinationen und, seltener, eine auf Muskelschwäche zurückzuführende Gangunsicherheit sowie depressive Verstimmungen auftreten. Gerade in den ersten Behandlungstagen sollte daher auf (aktives) Autofahren oder das Arbeiten mit gefährlichen Maschinen verzichtet werden (Reaktionsverlangsamung). Daneben können häufig Bewegungs- und Artikulationsstörungen, Benommenheit, Übelkeit und Erbrechen beobachtet werden (1–10 %). Es besteht zudem die Möglichkeit der Wirkungsumkehr, das heißt, es können beispielsweise akute Erregungszustände (Angst, Suizidalität, Schlafstörungen, Wutanfälle oder Muskelkrämpfe) eintreten.
Ferner kann es zur Ausbildung anterograder Amnesien kommen, welche prinzipiell bei allen Benzodiazepinen auftreten können.[5]
Tetrazepam kann schwere Hautreaktionen auslösen: So wurde das Auftreten des Stevens-Johnson-Syndroms (SJS), der toxischen epidermalen Nekrolyse (TEN), des Erythema multiforme sowie des DRESS-Syndroms (drug rash with eosinophilia and systemic symptoms) beobachtet. Aufgrund einer Entscheidung der europäischen Kommission ruht die Zulassung tetrazepamhaltiger Medikamente, bis das Nutzen-Risiko-Verhältnis geklärt ist (vgl. Rechtsstatus in Deutschland, Zulassung in anderen Ländern).
Abhängigkeitspotenzial
Der Wirkstoff Tetrazepam kann schon nach kurzer Einnahme zur Abhängigkeit führen. Bei Beendigung der Therapie mit Tetrazepam sollte die Dosis langsam verringert werden, da sonst schwere Entzugssyndrome sowohl psychisch als auch physisch eintreten können. Wird das Mittel abrupt abgesetzt, kann dies nach 2–4 Tagen Schlaflosigkeit zu vermehrtem Träumen führen. Darüber hinaus können sich Angst, Spannungszustände oder Depressionen verstärkt wieder einstellen.
Wechselwirkungen
Die Wirkung von anderen im Zentralnervensystem wirkenden Substanzen, insbesondere Alkohol, kann bei gleichzeitiger Einnahme mit Tetrazepam verstärkt werden.
Zentral wirkende Medikamente; Alkohol (gegenseitige Wirkungsverstärkung); Muskelrelaxanzien (deren Wirkung verstärkt sich); Cimetidin, Omeprazol (Tetrazepam-Wirkung wird gesteigert); Clozapin (Gefahr eines Atem-/Kreislaufversagens)
Da Tetrazepam über das Cytochrom-P450-Enzymsystem CYP 3A4 metabolisiert wird, können Hemmstoffe dieses Enzymsystems, wie z. B. Cimetidin oder auch Grapefruitprodukte, die Wirkung von Tetrazepam verstärken.
Rechtsstatus
1967 in Frankreich auf den Markt gebracht, ist Tetrazepam nur in wenigen europäischen Ländern, unter anderen in Deutschland und Österreich eingeführt worden, nicht aber in Großbritannien. Auch in den USA befand sich Tetrazepam nicht auf dem Markt.
Im Rahmen der Pharmakovigilanz wurde in Frankreich das Auftreten schwerer Hautreaktionen (siehe Abschnitt Nebenwirkungen) nach der Einnahme von Tetrazepam beobachtet mit teilweise tödlichem Ausgang. Die französische Arzneimittelbehörde ANSM empfahl ein nationales Vermarktungsverbot und veranlasste im Dezember 2012 die Einleitung eines europäischen Risikobewertungsverfahren mit dem Ziel eines europaweiten Verbots.[6][7] Auf Empfehlung des in der europäischen Arzneimittelagentur (EMA) angesiedelten Ausschusses zur Risikobewertung in der Pharmakovigilanz (Pharmacovigilance Risk Assessment Committee, PRAC)[8] entschied die Europäische Kommission im Mai 2013, Zulassungen für tetrazepamhaltige Arzneimittel in den Mitgliedsstaaten bis August 2015 ruhen und das Nutzen-Risiko-Verhältnis klären zu lassen.[9][10]
In Deutschland durften tetrazepamhaltige Arzneimittel daraufhin ab dem 1. August 2013 nicht mehr verschrieben und abgegeben werden.[11] Tetrazepam war bis dahin in der Bundesrepublik Deutschland aufgrund seiner Aufführung in der Anlage 3 zum Betäubungsmittelgesetz (BtMG) ein verkehrsfähiges und verschreibungsfähiges Betäubungsmittel. Das Ruhen der Zulassung wurde vom BfArM mehrmals jeweils um 2 Jahre verlängert, zuletzt befristet bis zum 31. Juli 2021.[12][13] Zum 15. Juli 2021 wurden in Deutschland die Zulassungen mit dem Wirkstoff Tetrazepam vom BfArM widerrufen.[14]
Siehe auch
Literatur
- Detlev Schneider, Frank Richling: Checkliste Arzneimittel A-Z. 5. Auflage. Thieme, Stuttgart 2008, ISBN 978-3-13-130855-9.
Einzelnachweise
- Eintrag zu Tetrazepam. In: Römpp Online. Georg Thieme Verlag, abgerufen am 7. Juli 2014.
- Eintrag zu Tetrazepam in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von Tetrazepam im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 12. Juli 2020.
- Christian Madler, Karl Werdan, Johannes Siegrist: Akutmedizin – Die ersten 24 Stunden: Das NAW-Buch, S. 783. Elsevier, Urban & Fischer Verlag, München 2009, ISBN 978-3-437-22511-6. Online: eingeschränkte Vorschau in der Google-Buchsuche.
- Aktories u. a.: Allgemeine und Spezielle Pharmakologie und Toxikologie 9. Aufl., S. 336, 337.
- Schwere Hautreaktionen unter Tetrazepam. Deutsches Ärzteblatt, 15. Januar 2013.
- Tetrazepam-containing medicines – Article-107i procedure – Rationale for triggering (PDF; 93 kB) vom 14. Januar 2013, European Medicines Agency (EMA).
- Tetrazepam-containing medicines, Verfahrensübersicht der europäischen Arzneimittelagentur (EMA).
- C(2013) 3344 final – Durchführungsbeschluss der Kommission vom 29. Mai 2013 betreffend die Zulassungen für die Humanarzneimittel mit dem Wirkstoff „Tetrazepam“ gemäß Artikel 107i der Richtlinie 2001/83/EG des Europäischen Parlaments und des Rates (PDF; 50 kB).
- Tetrazepamhaltige Arzneimittel (z. B. Musaril®): Anordnung des Ruhens der Zulassungen im Rahmen der Umsetzung der Kommissionsentscheidung. BfArM, 5. Juli 2013, abgerufen am 8. Mai 2017.
- Ruhen der Zulassung: Kein Tetrazepam ab 1. August 2013 – Mitteilung der Deutschen Apotheker Zeitung vom 24. Juni 2013.
- Weiterhin kein Tetrazepam. In: Deutsche Apothekerzeitung. 23. November 2017, abgerufen am 24. Juli 2021.
- Celine Müller: Tetrazepam: Zulassung ruht weiter. In: Deutsche Apothekerzeitung. 17. Juli 2019, abgerufen am 24. Juli 2021.
- Bescheid: Tetrazepamhaltige Arzneimittel - Negatives Nutzen-Risiko-Verhältnis wegen seltener aber schwerwiegender Hautreaktionen. Bundesinstituf für Arzneimittel und Medizinprodukte, 15. Juli 2021, abgerufen am 24. Juli 2021.