Tetramethylgermanium
Tetramethylgermanium, mit der Konstitutionsformel Ge(CH3)4, ist eine der einfachsten metallorganischen Germaniumverbindungen. Sie besteht aus einem zentralen Germaniumatom (Ge) mit vier daran gebundenen Methylgruppen (–CH3) und liegt bei Raumtemperatur als farblose Flüssigkeit vor.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
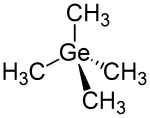 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Tetramethylgermanium | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H12Ge | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 132,78 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,978 g·cm−3 (25 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
43,4 °C[3] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Brechungsindex |
1,389 (20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Darstellung
Tetramethylgermanium lässt sich durch die Grignard-Reaktion aus Germaniumtetrachlorid und Methylmagnesiumchlorid synthetisieren.[3]
Ebenso ist eine Umsetzung von Germaniumtetrachlorid mit Dimethylzink oder Dimethylcadmium möglich, letzteres lässt sich aufgrund des höheren Siedepunkts besser vom entstehenden Produkt abtrennen. Die Umsetzung erfolgt bei Raumtemperatur nahezu quantitativ.[4]
Eigenschaften
Tetramethylgermanium ist eine ölige, farblose Flüssigkeit mit süßlichem Geruch, ähnlich dem Chloroform. Es löst sich unzersetzt in Ethanol, Diethylether und Benzin. Mit Salpetersäure reagiert es bei 0 °C nur langsam.[3]
Verwendung
Tetramethylgermanium kann als Methylierungsmittel in Transmetallierungsreaktionen eingesetzt werden:[5]
Einzelnachweise
- E. H. Brooks and F. Glockling: Tetramethylgermane. In: Robert W. Parry (Hrsg.): Inorganic Syntheses. Band 12. McGraw-Hill Book Company, Inc., 1970, ISBN 07-048517-8 (defekt), S. 58–59 (englisch).
- Datenblatt Tetramethylgermanium 98 % bei Sigma-Aldrich, abgerufen am 22. November 2011 (PDF).
- L. M. Dennis: Germanium. Zusammenfassung der Untersuchungen im Department of Chemistry, Cornell University, 1921-1927. In: Zeitschrift für anorganische und allgemeine Chemie. Band 174, Nr. 1, 2. August 1928, S. 97, doi:10.1002/zaac.19281740114.
- L.H. Long, C.I. Pulford+: The preparation and physical properties of highly pure tetramethylgermane. In: Journal of Inorganic and Nuclear Chemistry. 30, Nr. 8, August 1968, ISSN 0022-1902, S. 2071–2075. doi:10.1016/0022-1902(68)80199-X.
- H. Schmidbaur, W. Findeiss: A Simple Route to Organogallium Compounds. In: Angewandte Chemie International Edition in English. Band 3, Nr. 10, Oktober 1964, S. 696, doi:10.1002/anie.196406961.

