Tetracyanoethylen
Tetracyanoethylen – auch abgekürzt TCNE (TetraCyaNoEthylen) – ist eine hygroskopische organische Verbindung aus der Stoffgruppe der Nitrile und hat eine flache, ebene Struktur.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
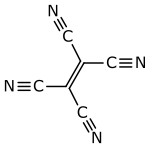 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Tetracyanoethylen | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C6N4 | |||||||||||||||
| Kurzbeschreibung |
rein: farblos, handelsüblich: beige bis gelbliche Masse[1][2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 128,09 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,35 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
223 °C[2] | |||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Darstellung und Reaktionen
Tetracyanoethylen wird durch Bromierung von Malonsäuredinitril in Gegenwart von Kaliumbromid hergestellt, wobei ein Kaliumbromid-Komplex erhalten wird, der anschließend mit Kupferpulver in der Hitze dehalogeniert wird.[5][1]
Oxidation von Tetracyanoethylen mit Wasserstoffperoxid führt zum entsprechenden Epoxid, welches für ein Epoxid ungewöhnliche chemische Eigenschaften aufweist.[3]
Eigenschaften
Tetracyanoethylen sublimiert bei 130–140 °C und 0,133 hPa.[1]
TCNE wird oft als Elektronenakzeptor eingesetzt. Cyanogruppen weisen *-Orbitale mit niedriger Energie auf, und die Gegenwart von vier solchen Gruppen, deren -Systeme durch die zentrale C=C-Doppelbindung verbunden (konjugiert) sind, ergibt einen hervorragenden Elektronenakzeptor. So reagiert TCNE mit Iodiden unter Bildung des Radikalanions.
Verwendung
Wegen der Planarität des Moleküls und seiner Fähigkeit, leicht Elektronen aufzunehmen, ist TCNE auch verwendet worden, eine Reihe organischer Supraleiter herzustellen – üblicherweise als ein-Elektron-Oxidationsmittel für einen organischen Elektrondonator. Solche Charge-Transfer-Komplexe werden manchmal Bechgaard Salze genannt.
Sicherheit
TCNE hydrolysiert in Wasser und an feuchter Luft zu sehr giftiger Blausäure. Entsprechende Vorsichtsmaßnahmen sollten beim Umgang mit der Substanz eingehalten werden.
Einzelnachweise
- R. A. Carboni: Tetracyanoethylene In: Organic Syntheses. 39, 1959, S. 64, doi:10.15227/orgsyn.039.0064; Coll. Vol. 4, 1963, S. 877 (PDF).
- Datenblatt Tetracyanoethylen (PDF) bei Merck, abgerufen am 24. April 2011.
- W. J. Linn: Tetracyanoethylene Oxide In: Organic Syntheses. 49, 1969, S. 103, doi:10.15227/orgsyn.049.0103; Coll. Vol. 5, 1973, S. 1007 (PDF).
- Datenblatt Tetracyanoethylene bei Sigma-Aldrich, abgerufen am 3. November 2016 (PDF).
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals, 14. Auflage, 2006, ISBN 978-0-911910-00-1, S. 1582.
