Tellurtrioxid
Tellurtrioxid ist eine chemische Verbindung und das Anhydrid der Orthotellursäure H6TeO6.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
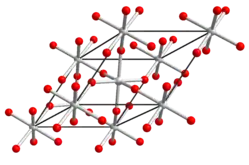 | |||||||||||||||||||
| _ Te6+ _ O2− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Tellurtrioxid | ||||||||||||||||||
| Andere Namen |
Tellur(VI)-oxid | ||||||||||||||||||
| Verhältnisformel | TeO3 | ||||||||||||||||||
| Kurzbeschreibung |
weißlich bis gelb-orangefarbener Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 175,60 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
5,07 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Eigenschaften
Es ist ein gelber, trigonal/rhomboedrisch kristallisierender Feststoff und existiert in zwei Modifikationen, der röntgenamorphen gelb-orangen α-Form und der grauen mikrokristallinen β-Form[4]. Diese kristallisiert trigonal, Raumgruppe R3c (Raumgruppen-Nr. 167) mit den Gitterparametern a = 5,195 Å und α = 56,38°.[5]
Gewinnung und Darstellung
Die gelb-orange Form entsteht bei der Entwässerung der Orthotellursäure bei ca. 300–320 °C.[6] Die gelbe Farbe kommt durch Elektronenübertrag des Sauerstoffs auf das Tellur („Charge-Transfer“) zustande. Die graue β-Form entsteht aus der Orthotellursäure im zugeschmolzenen Rohr bei 320 °C bei Anwesenheit von konzentrierter Schwefelsäure. Die β-Form ist wesentlich reaktionsträger. Das zeigt sich z. B. daran, dass es sich in Wasser, Säuren und sogar heißen Laugen nicht löst. Beide Formen des Tellurtrioxids zerfallen oberhalb von ca. 400 °C in Tellur(IV)-oxid und Sauerstoff.[7]
Einzelnachweise
- Webelements.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Doktorarbeit RWTH Aachen.
- M.A.K. Ahmed, H. Fjellvåg, A. Kjekshus: Synthesis, structure and thermal stability of tellurium oxides and oxide sulfate formed from reactions in refluxing sulfuric acid. In: Journal of the Chemical Society, Dalton Transactions, 2000, S. 4542–4549, doi:10.1039/B005688J.
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6.
- G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry, 2nd ed., vol. 1, Academic Press 1963, S. 450–451.