Telbivudin
Telbivudin oder L-Thymidin (Handelsname: Sebivo®, Hersteller: Novartis) ist das L-Enantiomer des Nukleosids Thymidin. Es wird bei erwachsenen Patienten als Arzneistoff zur Behandlung der chronischen Hepatitis B im Stadium der Virusreplikation (Virenvermehrung) eingesetzt.[3][4]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
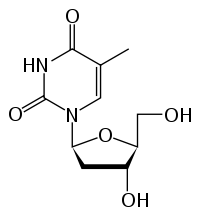 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Telbivudin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C10H14N2O5 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code |
J05AF11 | ||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 242,23 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Wirkungsmechanismus
Telbivudin wird durch Kinasen der Wirtszelle zu der aktive Triphosphat-Form phosphoryliert. Telbivudin-5’-Triphosphat hemmt die HBV-DNA-Polymerase (Reverse Transkriptase), weil es statt des natürlichen Substrats Thymidin-5’-Triphosphat in die Virus-DNA eingebaut wird. Die Anknüpfung weiterer Nukleotide ist strukturell nicht möglich und es resultiert ein DNA-Kettenabbruch, die HBV-Replikation wird gestoppt.
Nebenwirkungen
Als Nebenwirkungen werden u. a. Muskelerkrankungen, Verschlechterung der Nierenfunktion, Infektionen der oberen Luftwege, Müdigkeit und Unwohlsein, Bauchschmerzen, Nasopharyngitis, Kopfschmerzen, CPK-Erhöhung im Blut, Husten, Übelkeit und Erbrechen, Grippe und grippeartige Symptome, Schmerzen nach der Maßnahme, Diarrhö und ungeformter Stuhl sowie pharyngolaryngeale Schmerzen angegeben. Im Februar 2008[5] mussten klinische Studien mit einer Kombinationstherapie von Telbivudin und Interferon abgebrochen werden, da bei 8 von 48 (16,6 Prozent) Patienten eine periphere Neuropathie auftrat, davon fünf schwere Verläufe. Bei einer Monotherapie mit Telbivudin wurde eine Häufigkeit dieser Nebenwirkung von 0,6 Prozent beobachtet, die etwa nach zwei bis sechs Monaten Therapiedauer auftrat.
Entwicklung und Vermarktung
Telbivudin wurde im April 2007 durch die EU-Kommission europaweit zugelassen und kam im Mai 2007 in Deutschland auf den Markt. In einer Studie war Telbivudin nach einem Jahr wirksamer als das Standardmittel Lamivudin und es gab weniger resistenzbedingte Wirkungsverluste. Telbivudin selektiert dieselben resistenten Mutanten wie Lamivudin und ist deutlich teurer.
Einzelnachweise
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 1567–1568, ISBN 978-0-911910-00-1.
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 2,4(1H,3H)-Pyrimidinedione, 1-(2-deoxy-β-L-erythro-pentofuranosyl)-5-methyl- im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 12. Juli 2020.
- Zeitschrift für Chemotherapie. Jg. 2007, Nr. 4..
- Ching-Lung Lai et al.: Telbivudine versus lamivudine in patients with chronic hepatitis B. In: N. Engl. J. Med., 2007, Band 357, S. 2576–2588, PMID 18094378.
- Periphere Neuropathie bei Telbivudin. (Memento vom 12. August 2011 im Internet Archive) In: Deutsches Ärzteblatt.