Tecovirimat
Tecovirimat ist ein antiviraler Wirkstoff, der gegen Orthopoxviren wirksam ist. Vertreter dieser Virenfamilie lösen Krankheiten wie Pocken und Affenpocken aus.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
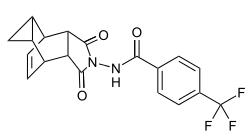 | |||||||||||||
| Allgemeines | |||||||||||||
| Freiname | Tecovirimat | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C19H15F3N2O3 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 376,34 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Tecovirimat ist in den USA – als bislang einziger Wirkstoff – gegen Pocken zugelassen,[2] seit 2022 auch in der EU. Das Mittel wurde bisher lediglich einmal zur Behandlung einer Frau eingesetzt,[3] die sich in einem Labor infiziert hatte.
Tecovirimat wurde als Gegenmittel für Pockenviren entwickelt, um auf einen eventuellen Einsatz dieses Erregers als biologischer Kampfstoff vorbereitet zu sein. Zwei Millionen Dosen von Tecovirimat sind in den nationalen strategischen Vorräten der USA vorhanden, sollte ein Angriff durch eine pockenvirenbasierte chemische Waffe (Biokampfstoffangriff) erfolgen.[4][5]
Klinische Studien
Die Ergebnisse klinischer Studien über Tecovirimat unterstützen die Annahme, dass er wirksam ist gegen Pocken und andere zusammenhängende Erreger. Er zeigte eine potentielle Wirksamkeit gegen verschiedene Variationen inklusive der Prophylaxe und kann als Ergänzung zur Impfung eingesetzt werden.
Der Wirkstoff blockiert die zelluläre Übertragung des Virus. Tecovirimat war in Labortests wirksam: Es schützte Tiere vor Affen- und Kaninchenpocken. Die Sicherheit für den Menschen wurde an 359 gesunden Probanden ohne Pockeninfektion untersucht. Die häufigsten Nebenwirkungen waren Kopfschmerzen, Übelkeit und Bauchschmerzen.[2]
Wirkungsmechanismus
Tecovirimat hemmt die Aktivität des viralen Proteins p37, das bei Orthopoxviren an der Bildung der Virushülle und der Freisetzung der Viren aus den infizierten Zellen beteiligt ist. Durch die Unterdrückung der Bildung von Virionen wird die Ausbreitung des Virus im Körper verhindert.[6]
Entwicklung
Ursprünglich wurde Tecovirimat am National Institute of Allergy and Infectious Diseases entdeckt und durch Viropharma in Zusammenarbeit mit Wissenschaftlern der United States Army Medical Research Institute of Infectious Diseases (USAMRIID) weiter erforscht. Mittlerweile wird es von Siga Technologies produziert, einem pharmazeutischen Unternehmen, das zur Verteidigung gegen biologische Waffen forscht und nach einer Ausschreibung der USA das Medikament unter einem behördlichen Vertrag entwickelte.
Wegen seiner Wichtigkeit zur Biokampfstoffabwehr, hatte die amerikanische Behörde Food and Drug Administration (FDA) Tecovirimat einen Status zur schnellen Bearbeitung verliehen.[2] Am 13. Juli 2018 gab die FDA die Zulassung von Tecovirimat bekannt.[2]
Im Januar 2022 erfolgte eine Zulassung in der EU (marketing authorisation under exceptional circumstances).[7] Das Anwendungsgebiet umfasst die Behandlung von Pocken, Affenpocken und Kuhpocken bei Erwachsenen und Kindern mit einem Körpergewicht von mindestens 13 kg. Tecovirimat ist ferner zur Behandlung von Komplikationen aufgrund der Replikation des Vacciniavirus nach einer Impfung gegen Pocken angezeigt.[8]
Tecovirimat hat in den USA den Status eines Arzneimittels gegen selten Krankheiten.[9]
Synthese
Tecovirimat kann auf verschiedene Weise synthetisiert werden. Eine mögliche Reaktionsführung beginnt mit der Umsetzung von Cycloheptatrien mit Maleinsäureanhydrid. Bei dieser Diels-Alder-Reaktion wird der verbrückte Bicyclus des Tecovirimats gebildet. Anschließend wird eine nucleophile Acylsubstitution von Hydrazin am Anhydrid durchgeführt. Dafür wird ein Stickstoffatom des Hydrazins durch eine BOC-Schutzgruppe abgeschirmt. Das Produkt der Substitution wird in saurer Lösung entschützt und anschließend mit einem 4-Trifluormethylbenzolsäurehalogenid umgesetzt. Bei dieser nucleophilen Acylsubstitution verlässt das Halogenid das Molekül als Abgangsgruppe. Nach der Aufreinigung durch Säulenchromatographie wird Tecovirimat in der Endo-Konfiguration als weißer kristalliner Feststoff gewonnen.[10]
Andere Möglichkeiten der Reaktionsführung arbeiten in der Regel mit denselben Edukten. Jedoch ist die Reihenfolge der Reaktionsschritte vertauschbar. Dadurch unterscheiden sich auch die Zwischenprodukte und damit auch die benötigten Lösemittel und Aufreinigungen der verschiedenen Synthesewege.[10]
Fertigarzneimittel
Tpoxx (USA), Tecovirimat SIGA (EU). Hersteller/Zulassungsinhaber: Siga Technologies
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Office of the Commissioner: Press Announcements - FDA approves the first drug with an indication for treatment of smallpox. Abgerufen am 12. Oktober 2018 (englisch).
- focus.de: Virus galt als ausgestorben: US-Forscherin infiziert sich versehentlich mit Pocken. 28. November 2019, abgerufen am 28. Juni 2021.
- Inger K. Damon, Clarissa R. Damaso, Grant McFadden: Are We There Yet? The Smallpox Research Agenda Using Variola Virus. In: PLoS Pathogens. Band 10, Nr. 5, 1. Mai 2014, doi:10.1371/journal.ppat.1004108, PMID 24789223, PMC 4006926 (freier Volltext).
- Aimee Cunningham: FDA approves the first smallpox treatment. In: Science News. 13. Juli 2018 (sciencenews.org [abgerufen am 12. Oktober 2018]).
- Guang Yang, Daniel C. Pevear, Marc H. Davies, Marc S. Collett, Tom Bailey: An Orally Bioavailable Antipoxvirus Compound (ST-246) Inhibits Extracellular Virus Formation and Protects Mice from Lethal Orthopoxvirus Challenge. In: Journal of Virology. Band 79, Nr. 20, Oktober 2005, S. 13139–13149, doi:10.1128/JVI.79.20.13139-13149.2005, PMID 16189015, PMC 1235851 (freier Volltext).
- Durchführungsbeschluss der Kommission vom 6.1.22 über die Genehmigung für das Inverkehrbringen des Humanarzneimittels "Tecovirimat SIGA - Tecovirimat" unter besonderen Bedingungen gemäß der Verordnung (EG) Nr. 726/2004 des Europäischen Parlaments und des Rates, EC, 6. Januar 2022.
- Tecovirimat SIGA: Opinion European Medicines Agency, 12. November 2021. Abgerufen am 15. Januar 2022.
- FDA, Orphan Drug Designations and Approvals: 316210, 233506, 229806. Abgerufen am 15. Januar 2020.
- Methods of preparing tecovirimat. 14. August 2013 (google.com [abgerufen am 28. Juni 2021]).