Tasimelteon
Tasimelteon ist ein Arzneistoff aus der Gruppe der Schlafmittel (Hypnotika), der in der Behandlung der Nicht-24-Stunden-Schlaf-Wach-Störung eingesetzt wird.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Tasimelteon | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C15H19NO2 | |||||||||||||||||||||
| Kurzbeschreibung |
weißes kristallines Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
N05CH03 | |||||||||||||||||||||
| Wirkstoffklasse |
Hypnotika | |||||||||||||||||||||
| Wirkmechanismus |
Melatoninrezeptor-Agonist[2] | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 245,31 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
gut löslich in Cyclohexan, Methanol, 95 % Ethanol, Wasser, 0,1 N HCl[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Chemische und physikalische Eigenschaften
Tasimelteon besitzt zwei Stereozentren. Neben dem arzneilich verwendeten trans-1R,2R-Isomer (in der Abbildung links oben) existieren somit drei weitere Stereoisomere, die in der Synthese nicht entstehen.

Tasimelteon ist eine weiße bis cremefarbene kristalline nicht-hygroskopische Substanz, in Wasser bei physiologisch relevanten pH-Werten löslich und gut löslich in Alkoholen, Cyclohexan und Acetonitril.
Die Verbindung tritt in zwei Kristallformen auf. Dabei handelt es sich um ein bei 74 °C schmelzendes Anhydrat und um eine Hemihydrat.[4] Das Hemihydrat gibt ab etwa 35 °C das Hydratwasser ab und wandelt sich dabei in die Anhydratform um.[4] Das Anhydrat kristallisiert in einem monoklinen Gitter mit der Raumgruppe P21 (Raumgruppen-Nr. 4), das Hemihydrat in einem tetragonalen Gitter mit der Raumgruppe P43212 (Nr. 96).[4]
Klinische Angaben
Tasimelteon ist in den USA seit Januar 2014 als Hetlioz (Vanda Pharmaceuticals) zugelassen zur Behandlung der Nicht-24-Stunden-Schlaf-Wach-Störung (non-24-hour sleep-wake disorder, Non-24).[6]
In Europa wurde Hetlioz als Orphan-Arzneimittel[7] für die Behandlung der Nicht-24-Stunden-Schlaf-Wach-Störung von Blinden ohne jegliche Lichtwahrnehmung im Juli 2015 zugelassen. Die Wirksamkeit wurde in zwei randomisierten, doppelblinden, placebokontrollierten, multizentrischen Parallelgruppenstudien (SET und RESET) bei völlig blinden Patienten mit Non-24 nachgewiesen.[8]
Das Arzneimittel wird peroral angewendet und ist verschreibungspflichtig.
Pharmakologische Eigenschaften
Wirkungsmechanismus (Pharmakodynamik)
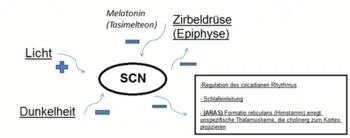
Tasimelteon fungiert pharmakodynamisch als Agonist an den Melatoninrezeptoren 1 und 2 (Bindungsaffinität MT1 Ki: 0,35 nM, MT2 Ki: 0,17 nM). Als Gi-Protein-gekoppelte Rezeptoren modulieren Melatoninrezeptoren die Neuronenaktivität von anatomisch spezifischen bzw. wachheitsbestimmenden Neuronennetzwerken wie dem Nucleus suprachiasmaticus und dem aufsteigenden retikulären System in der Formatio reticularis.[9][2][10][11][12][13][14][6] Es imitiert die physiologische Wirkung von endogenem Melatonin, das zur Regulation des circadianen Rhythmus notwendig ist und nur bei Dunkelheit von der Epiphyse sezerniert wird bzw. seine Höchstkonzentration erreicht.
Die Lokalisation der Melatoninrezeptoren findet sich primär in der Hypophyse und im Nucleus suprachiasmaticus (MT1) einem Kerngebiet im Hypothalamus und der Netzhaut (MT2) wieder.
Der Wirkungsmechanismus von Tasimelteon lässt sich an dem Schema der physiologischen Melatoninwirkung nachvollziehen (s. Abb.).
Unter dem Einfluss von Licht kommt es durch Übermittlung von der Netzhaut zu einer Aktivierung des Nucleus suprachiasmaticus, der seinerseits die Melatoninsekretion in der Zirbeldrüse hemmt. Durch die abnehmende Melatoninkonzentration wird die Aktivität des Nucleus suprachiasmaticus gesteigert. In der Folge wird die Schlafaufrechterhaltung durch eine aktive Hemmung der Interneurone, welche die spezifischen bzw. unspezifischen Thalamuskerne hemmen, vom N. suprachiasmaticus beendet, was der normalen Aufwachphase am Morgen entspricht.
Da nun die spezifischen und unspezifischen Thalamuskerne erregend auf die gesamte Hirnrinde einwirken können, wird so intuitiv verständlich, dass dies eine kortikale Reizverarbeitung erzwingt und ein Weiterschlafen nicht möglich macht. Unter dem Einfluss von Dunkelheit kommt es zu einer Aktivitätsabnahme des N. suprachiasmaticus, was einer Aktivierung (Hemmung der Hemmung bzw. Disinhibition) der Zirbeldrüse entspricht und somit die Melatoninkonzentration bzw. -sekretion auslöst, die ihrerseits aktiv über Melatoninrezeptoren (MT1) den N. suprachiasmaticus hemmen. Hierdurch kommt es zur Aktivierung der hemmenden thalamischen Interneurone, welche die in den Kortex projizierenden Neurone der spezifischen und unspezifischen Thalamuskerne hemmen, was der physiologischen Einschlafphase entspricht. Hier wird aktiv die kortikale Informationsverarbeitung reduziert, dass subjektiv dem Gefühl des Ermüdens entspricht. Der Arzneistoff Tasimelteon imitiert das Hormon Melatonin, was wie zuvor erläutert bei vorzeitiger Einnahme zu einer Vorverlegung des normalen circadianen Rhythmus führt bzw. bei Biosynthesestörungen (Enzymmangel; Mutationen), Blindheit oder schweren Netzhautschäden die „Melatonin-induzierte-Tiefschlafphase“ verstärkt, als auch die Einschlafphase verkürzt und die Durchschlafphase verlängert.[2][15]
Aufnahme und Verteilung im Körper (Pharmakokinetik)
Tasimelteon besitzt eine orale Bioverfügbarkeit von ca. 80 %. Die Halbwertszeit wird mit 1,3 ± 0,4 Stunden angegeben. Nach der Resorption liegt Tasimelteon zu ca. 90 % an Plasmaproteine gebunden vor.[2] Die Metabolisierung erfolgt primär in der Leber durch CYP 1A2, CYP 3A4 und CYP 2C19.[2]
Die Eliminierung des biotransformierten Wirkstoffs erfolgt zu ca. 80 % über die Nieren und ca. zu 4 % über die Faeces.[2]
Toxikologie
Zur Mutagenität wurden sowohl ein Ames-Test als auch ein Mikronukleus-Test durchgeführt, die beide kein mutagenes Potential des Wirkstoffs Tasimelteon anzeigen.
Auch konnte im Tierversuch (Ratten) keine Kanzerogenität festgestellt werden, allerdings eine Reduzierung der Fruchtbarkeit.[2]
Fertigarzneimittel
Hetlioz Kapseln 20 mg (EU, USA).[16]
Einzelnachweise
- rxlist.com
- Vanda Pharmaceuticals: Tasimelteon – Advisory Committee Meeting Briefing Materials, 14. November 2013, publiziert auf der Webseite der FDA, abgerufen am 19. Juli 2014.
- newdrugapprovals.org
- Kaihang Liu, Xinbo Zhou, Zhejing Xu, Hongzhen Bai, Jianrong Zhu, Jianming Gu, Guping Tang, Xingang Liu, Xiurong Hu: Anhydrates and hemihydrate of tasimelteon: Synthesis, structure, and pharmacokinetic study in J. Pharm. Biomed. Anal. 151 (2018) 235–243, doi:10.1016/j.jpba.2017.12.035.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Hetlioz™ (tasimelteon) capsules 20 mg, Prescribing Information", Vanda Pharmaceuticals Inc. 12. Dezember 2014 (fda.gov [PDF]).
- EU/3/10/841
- Hetlioz - Zusammenfassung der Merkmale des Arzneimittels. Abgerufen am 20. April 2019.
- Alfred Benninghoff: Anatomie 2, Makroskopische Anatomie, Histologie, Embryologie, Zellbiologie. Herz-Kreislauf-System, Lymphatisches System, Endokrines System, Nervensystem, Sinnesorgane, Haut. Urban & Fischer/Elsevier, München, ISBN 3-437-42350-9.
- S. Rivara, M. Mor, A. Bedini, G. Spadoni, G. Tarzia: Melatonin Receptor Agonists: SAR and Application to the Treatment of Sleep–Wake Disorders. In: Current Topics in Medicinal Chemistry. 8 (11), 2008, S. 954–968. doi:10.2174/156802608784936719
- S. A. Ferguson, S. M. W. Rajaratnam, D. Dawson: Melatonin agonists and insomnia. In: Expert Reviews. 10 (2) 2010, S. 305–318, doi:10.1586/ern.10.1.
- Takeda Pharmaceuticals North America, Inc. Tpna.com. Abgerufen am 10. Februar 2012.
- Prolonged-Release Melatonin | Circadin®". Circadin.com. 1. Februar 2012, Abgerufen am 10. Februar 2012.
- Servier". Valdoxan.com. Abgerufen am 10. Februar 2012.
- Darius. P. Zlotos, Ralf Jockers, Erika Cecon, Silvia Rivara, Paula A. Witt-Enderby: MT1 and MT2 Melatonin Receptors: Ligands, Models, Oligomers, and Therapeutic Potential. In: Journal of Medicinal Chemistry. 57 (8), 2014, S. 3161–3185. doi:10.1021/jm401343c
- hetlioz.com