Swarts-Reaktion
Die Swarts-Reaktion ist eine Namensreaktion der organischen Chemie, die erstmals 1892 von Frédéric Swarts beschrieben wurde. Mithilfe dieser Reaktion lassen sich Fluor- und Chlorfluorkohlenwasserstoffe darstellen. Es werden unpolare, meist aliphatische, organische Polyhalogenide mit Antimontrifluorid in Gegenwart von Antimonpentachlorid oder Chlor teilweise fluoriert.[1]
Übersichtsreaktion
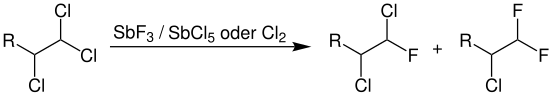
Bei der Swarts-Reaktion wird ein organisches Polyhalogenid (hier ein Trichlorid, R = Alkyl- oder Arylgruppe) mit Antimontrifluorid und Antimonpentachlorid oder Chlor fluoriert. Das Gemisch aus Antimontrifluorid und Chlor wird auch als Swarts-Reagenz bezeichnet.[1]
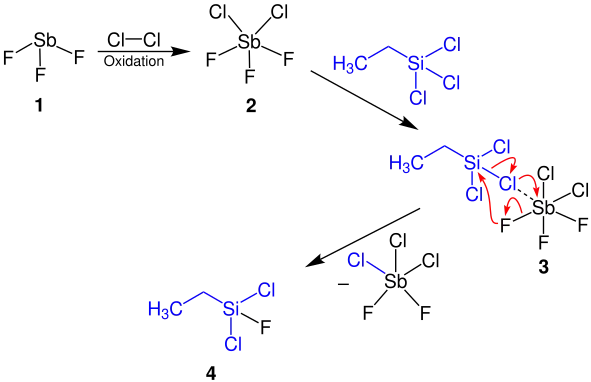
Reaktionsmechanismus
Durch die Zugabe von Chlor zu Antimontrifluorid 1 bildet sich Antimondichloridtrifluorid 2. Wird ein Halogenalkan (hier Trichlorethylsilan) zugegeben, findet, wie in 3 ersichtlich, ein Austausch des Halogen-Atoms (hier ein Chlor-Atom) gegen ein Fluor-Atom statt. Mit den hier verwendeten Reagenzien bildet sich daraus das fluorierte Reaktionsprodukt 4.[1]
Modifikation
Neben Antimontrifluorid werden gelegentlich auch Aluminium-, Chrom-, Silber-, Thallium-, Quecksilber-, Zink- und Zirconiumfluoride verwendet.[2][3] Statt den Weg über die Swarts-Reaktion zu gehen, können außerdem Fluor und verschiedene Fluoride (z. B. Interhalogenverbindungen, Xenon-Fluor-Verbindungen, Flusssäure etc.) an eine C=C-Doppelbindung addiert oder C–H-Bindungen direkt fluoriert werden.[1]
Anwendung
Die Substitution von Chlor durch Fluor mithilfe der Swarts-Reaktion resultiert in einer Erniedrigung des Siedepunkts des Produktes, wobei jedes zusätzliche Fluor-Atom in der Verbindung einen nahezu identischen Beitrag zur Siedepunktserniedrigung beiträgt.[1] Dieses Phänomen wird sich beispielsweise in der Forschung im Bereich der Anästhetika zunutze gemacht, indem verschiedene Etherverbindungen fluoriert werden. Die so gewonnenen Flurane zeichnen sich durch einen hohen Dampfdruck, eine hohe Stabilität und einen niedrigen Siedepunkt aus und gehören zu den bedeutendsten Inhalations-Narkotika.[4]
Siehe auch
Einzelnachweise
- Swarts Reaction. In: Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, Inc., Hoboken, NJ, USA 2010, ISBN 978-0-470-63885-9, S. 2744–2747, doi:10.1002/9780470638859.conrr615.
- Martha Windholz, Susan Budavari, Lorraine Y. Stroumtsos, Margaret Noether Fertig: The Merck Index. 9. Auflage. Merck & Co., Inc., Rahway, U.S.A. 1976, ISBN 0-911910-26-3, S. ONR-86–87.
- Chambers, R. D. (Richard D.): Fluorine in organic chemistry. [Rev. and updated ed.]. Blackwell Pub., Oxford 2004, ISBN 0-8493-1790-8, S. 24–26.
- Ross C. Terrell, Louise Speers, Alex J. Szur, Thomas Ucciardi, James F. Vitcha: General anesthetics. 3. Fluorinated methyl ethyl ethers as anesthetic agents. In: Journal of Medicinal Chemistry. Band 15, Nr. 6, Juni 1972, S. 604–606, doi:10.1021/jm00276a008.