Silberhydroxid
Silberhydroxid (Silber(I)-hydroxid), chemische Formel AgOH, ist als Hydroxid des Silbers eine Base. Das sich als Zwischenstufe zum bräunlichen und schwer löslichen Niederschlag von Silber(I)-oxid bildende Silberhydroxid kann z. B. elektrolytisch[4] oder aus neutraler wässriger Silbernitrat-Lösung unter äquimolarer Zugabe der Base NaOH gebildet werden. Silberhydroxid steht unter Abspaltung von Wasser mit dem ebenfalls schwer löslichen, stabileren Silber(I)-oxid Ag2O im Gleichgewicht.[5]
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
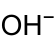 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Silberhydroxid | ||||||||||||
| Andere Namen |
Silber(I)-hydroxid | ||||||||||||
| Summenformel | AgOH | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 124,88 g·mol−1 | ||||||||||||
| pKS-Wert |
3,96 (25 °C)[1] | ||||||||||||
| Löslichkeit |
schlecht löslich in Wasser und Methanol[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Für die Gleichgewichtsreaktion von Silberhydroxid zu Silberoxid ergibt sich für die Gleichgewichtskonstante K ein Wert von 1,33 · 10−3, wobei im Gleichgewicht deutlich weniger Ag2O als AgOH in der Lösung vorliegt.[6]
Darstellung
- Silbernitrat wird in Wasser gelöst. Unter Rühren wird diese Silbernitrat-Lösung in eine Natronlauge eingerührt. Der entstandene Silberhydroxid-Niederschlag wird abgesaugt, mit Wasser und anschließend mit Methanol gewaschen.[2]
- Aus wasserfreier alkoholischer Lösung kann Silberhydroxid ohne Bildung von Silberoxid gefällt werden.[5]
Reaktionen
Eine Aufschlämmung von Silber(I)-oxid in Wasser reagiert deutlich alkalisch, da in Umkehrung der oben aufgeführten Reaktion aus Silberoxid die Base Silberhydroxid gebildet wird.[5]
Die Fällung von AgOH aus wässriger Lösung beginnt bei pH-Wert 8,3 und ist beim pH-Wert von 11,3 abgeschlossen[7]. Als amphoteres Hydroxid geht AgOH bei noch höheren pH-Werten wieder in Lösung; so bildet sich im Überschuss einer stark alkalischen Lösung aus Silberhydroxid das lösliche Silberhydroxid-Anion [Ag(OH)2]−:
Durch Zugabe von konzentrierter Ammoniak-Lösung bildet sich aus Silberhydroxid der wasserlösliche Diamminsilber(I)-komplex [Ag(NH3)2]+.
Verwendung in der präparativen Chemie
- Aus den wasserlöslichen Halogeniden Chlorid, Bromid und Iodid können in methanolischer Lösung mit einer Silberoxid-Suspension bequem und ohne Nebenreaktionen die entsprechenden Hydroxide dargestellt werden.
- Die Substitution eines Chlor- oder Iod-Liganden (–Cl bzw. –I) durch eine Hydroxygruppe (–OH) ist in einigen organischen Verbindungen durch die Umsetzung mit AgOH möglich (Beispiele: Die Reaktion von Chlorbernsteinsäure mit Silberhydroxid führt zur Äpfelsäure unter Bildung von AgCl; die Überführung von Iodethan zu Ethanol).[8]
- Quartäre Ammoniumhalogenide können mit AgOH in die entsprechenden, halogenidfreien quartären Ammoniumhydroxide überführt werden.[9]
- Historische Möglichkeit zur Darstellung von kolloidalem Silber: In einer alkalischen Lösung des Natriumsalzes der Protalbin- bzw. Lysalbinsäure reduziert Hydrazinhydrat AgOH zu kolloidalem Silber, das sehr beständig ist.[10]
- Tartronsäure (Hydroxymalonsäure) entsteht durch Hydrolyse von Monobromalonsäure mit Silberhydroxid.
Siehe auch
- Tollensprobe: Nachweis für Aldehyde bzw. reduzierende funktionelle Gruppen durch Reduktion von Silber(I)-Ionen zu metallischem Silber
- Cyclopropen: Synthese von Cyclopropen mit Silberhydroxid und Methyliodid (CH3I)
Einzelnachweise
- Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. Springer DE, 1997, ISBN 3-540-60035-3, S. 1057 (eingeschränkte Vorschau in der Google-Buchsuche).
- Chemical Abstracts, Band 95, No. 19, 9. November 1981, Columbus, Ohio, USA, M. MASSACCESI "Two-phase titration of some quaternary ammonium compounds in the presence of amines or other quaternary ammonium compounds", Seite 437.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Die Theorie von kolloidalem Silber (engl.)
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1460.
- George Biedermann, Lars Gunnar Sillén: Studies on the Hydrolysis of Metal Ions. Part 30. A Critical Survey of the Solubility Equilibria of Ag2O. In: Acta Chemica Scandinavica. 1960, 14, S. 717, doi:10.3891/acta.chem.scand.14-0717.
- Jander Blasius, Lehrbuch der analytischen und präparativen anorganischen Chemie, Stuttgart-Leipzig, 1995, 14. Auflage
- Römpp Lexikon Chemie, Bd. 5, 9. Aufl., S. 4159.
- Patent EP0201055B1: Verfahren zur Herstellung von halogenidfreien quaternären Ammoniumsalzen. Angemeldet am 2. Mai 1986, veröffentlicht am 15. Mai 1991, Anmelder: Hoechst Aktiengesellschaft, Erfinder: Bernhard Wojtech et al.
- C. Paal, Über colloidales Silber, Ber. Dtsch. Chem. Gesellsch. 35 (1902), S. 2224–2236.