Salcomin
Salcomin (auch: Co(salen)) ist ein Cobalt-Komplex. Die Verbindung wurde erstmals 1933 von Paul Pfeiffer synthetisiert.[5]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
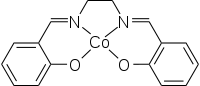 | |||||||||||||||||||
| Kristallsystem |
monoklin | ||||||||||||||||||
| Raumgruppe |
C2/c (Nr. 15) | ||||||||||||||||||
| Gitterparameter |
a = 26,380(5) Å, b = 7,105(5) Å, c = 14,470(5) Å, β = 97,96(2)°[1] | ||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Salcomin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C16H14CoN2O2 | ||||||||||||||||||
| Kurzbeschreibung |
rotbrauner, kristalliner Feststoff[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 325,21 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Etymologie
Der Name Salcomin ist ein Kunstwort, welches sich aus den Worten Salicylaldehyd, Cobalt und Ethylendiamin zusammensetzt.[2]
Darstellung
Nach Synthese des salen-Liganden durch Umsetzen von Ethylendiamin mit Salicylaldehyd in Ethanol kann die Verbindung durch anschließende Zugabe eines Cobaltsalzes wie Cobalt(II)-acetat dargestellt werden.[6][7]
Eigenschaften
Der Komplex besitzt eine quadratisch-planare Struktur. Die Verbindung ist paramagnetisch, das effektive magnetische Moment wird in Einheiten des Bohrschen Magneton mit 2,28[8] bis 2,75[9] bei Raumtemperatur angegeben.
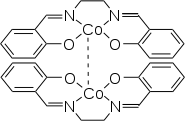 Aktive Form von Salcomin
Aktive Form von Salcomin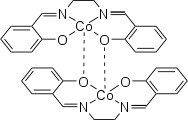 Inaktive Form von Salcomin
Inaktive Form von Salcomin
Salcomin existiert in einer aktiven und einer inaktiven Modifikation: Die besondere Eigenschaft der aktiven Form ist, dass diese in der Lage ist, bei Raumtemperatur Sauerstoff aus der Umgebungsluft zu binden (bis zu 4,9 Gew.-% Sauerstoff) und diesen nach Erwärmen auf 50–60 °C wieder abzugeben.[5] Aus diesem Grund sollte die Verbindung unter Schutzgas gelagert werden.[4]
Beide Modifikationen liegen unter Standardbedingungen als Dimere vor. Bei der aktiven Form besteht eine lose Bindung zwischen den beiden Cobaltatomen, während in der inaktiven Form die Sauerstoffatome der Liganden an beide Cobaltatome binden.[7]
Die inaktive Form kristallisiert in der monoklinen Raumgruppe C2/c (Raumgruppen-Nr. 15) mit den Gitterkonstanten a = 26,380(5) Å, b = 7,105(5) Å, c = 14,470(5) Å, β = 97,96(2)° und Z = 8.[1]
Verwendung
Auf Seite der Alliierten wurde im Zweiten Weltkrieg Salcomin zur Gewinnung von Sauerstoff genutzt.
Anwendung findet der Komplex auch als Initiator in der radikalischen Polymerisation bzw. auch als Kettentransferreagenz genutzt werden. In der organischen Chemie findet Salcomin Anwendung als Katalysator beispielsweise in der Oxidation von Benzylalkohol zu Benzaldehyd. Die kinetische Racematspaltung kann mit chiralen Salcomin-Derivaten durchgeführt werden.[5]
Einzelnachweise
- S. L. Holt, R. DeIasi, B. Post: Crystal structure of the oxygen-inactive form of bis(salicylaldehyde)ethylenediiminecobalt(II). In: Inorganic Chemistry. Band 10, Nr. 7, Juli 1971, S. 1498–1500, doi:10.1021/ic50101a036.
- Margot Becke-Goehring, Harald Hoffmann: Komplexchemie. Vorlesungen über Anorganische Chemie Von Margot Becke-Goehring. Springer, 2013, ISBN 978-3-642-87215-0, 2.10, S. 93–94 (eingeschränkte Vorschau in der Google-Buchsuche [abgerufen am 20. März 2019]).
- Datenblatt N,N’-Bis(salicylidene)ethylenediaminecobalt(II) bei AlfaAesar, abgerufen am 20. März 2019 (PDF) (JavaScript erforderlich).
- Datenblatt N,N’-Bis(salicylidene)ethylenediaminocobalt(II) bei Sigma-Aldrich, abgerufen am 20. März 2019 (PDF).
- Eintrag zu Salcomin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. März 2019.
- Patent EP0704428A1: Angemeldet am 19. September 1995, veröffentlicht am 3. April 1996, Anmelder: Evonik Degussa, Erfinder: Frank Dr. Hübner, Ulrich Gora, Klaus Dr. Huthmacher, Karlheinz Prof. Dr. Drauz.
- Trevor G. Appleton: Oxygen uptake by a cobalt(II) complex. An undergraduate experiment. In: Journal of Chemical Education. Band 54, Nr. 7, Juli 1977, S. 443–444, doi:10.1021/ed054p443.
- J. Manasen: Structure of cobalt(II) complexes with quadridentate schiff bases in solution and the solid state. In: Inorganic Chemistry. Band 9, Nr. 4, April 1970, S. 966–968, doi:10.1021/ic50086a057.
- D. N. Kumar and B. S. Garg: Some new cobalt(II) complexes. Synthesis, characterization and thermal studies. In: Journal of Thermal Analysis and Calorimetry. Band 69, Nr. 6, August 2002, S. 607–616, doi:10.1023/A:1019976226610.
