Roush-Reaktion
Die Roush-Reaktion (auch Roush-Crotylborierung oder Roush asymmetrische Allylierung genannt) ist eine Namensreaktion der Organischen Chemie. Sie geht auf den US-amerikanischen Chemiker William R. Roush (* 1952) aus dem Jahr 1985 zurück und dient der enantioselektiven Herstellung von chiralen Alkoholen.[1][2] Das gewünschte Enantiomer kann dabei mit einem Enantiomerenüberschuss von 71–87 % erhalten werden.[2][3]

Übersichtsreaktion und Stereoselektivität
Das grundlegende Prinzip der Roush-Reaktion ist die Bildung eines Alkohols aus einem Aldehyd unter Knüpfung einer neuen Kohlenstoff-Kohlenstoff-Bindung. Dabei ist es für diese Namensreaktion charakteristisch, dass der Alkohol ein Homoallylalkohol ist. Dies ist ein Alkohol, bei dem sich die Hydroxygruppe am vierten Kohlenstoff-Atom nach einer Doppelbindung befindet.[4] Zu dieser Homoallyl-Situation kommt es, da im Laufe der Reaktion eine Atombindung neu geknüpft wird, die im Bild rot markiert ist. Eine grobe Übersichtsreaktion für die Roush-Reaktion sieht wie folgt aus:[1][3]

Wird diese Übersichtsreaktion genauer betrachtet, fällt auf, dass es sich bei dem Aldehyd um eine prochirale Verbindung, bei dem Homoallylalkohol hingegen um eine chirale Verbindung handelt, bei der die Hydroxygruppe entweder syn- oder anti-ständig ist. Weiterhin ist noch nicht abschließend geklärt, wie es zu der Homoallyl-Stellung kommt. Um diese Unklarheiten zu beseitigen, muss die Reaktion genauer betrachtet werden:
Roush nutze für die Synthese des Homoallylalkohols neben dem Aldehyd ein Crotylboronat:[2]
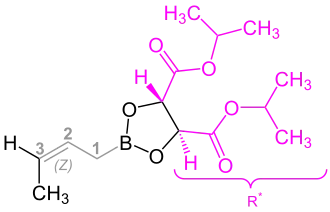
Dieses Crotylboronat enthält zum einen chirale Reste , die zusammen mit Substituenten, z. B. einer Methylgruppe, an dem dritten Kohlenstoff-Atom in (E)- oder (Z)-Anordnung die Stereochemie des entstehenden Alkohols bestimmen. Zum anderen verfügt diese Verbindung über eine Allyl-Gruppe , an die der Aldehyd addiert wird. Dies führt zur Homoallyl-Stellung der Hydroxygruppe in dem sich bildenden Alkohol.[3][1]
Wird ein (Z)-Crotylboronat [(Z)-2] eingesetzt, entsteht als Hauptprodukt der syn-Homoallylalkohol (syn-3). Mit einem (E)-Crotylboronat [(E)-2] bildet sich ein anti-Homoallylalkohol (anti-3) als Hauptprodukt. Die Übersichtsreaktion sieht demnach wie folgt aus:[3]
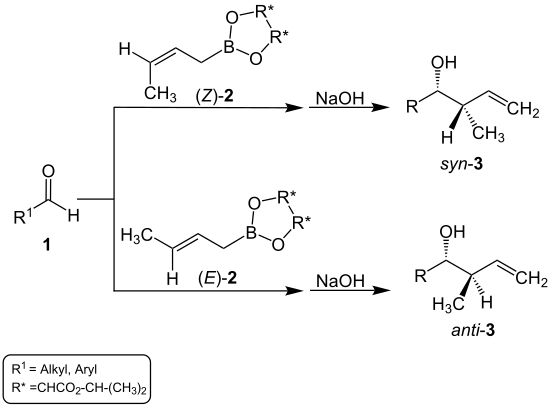
Annahmen darüber, wie der genaue Mechanismus abläuft und warum bei der Reaktion von (Z)-2 der syn-Homoallylalkohol (syn-3) als Hauptprodukt und mit (E)-2 der anti-Homoallylalkohol (anti-3) als Hauptprodukt gebildet wird, lassen sich bei Roush und Kürti nachlesen.[2][3]
Atomökonomie
Eine chemische Reaktion ist aus atomökonomischer Sicht als effizient anzusehen, wenn alle Komponenten der Edukte in das gewünschte Hauptprodukt überführt werden, wie es bei Additionsreaktionen in der Regel der Fall ist.[5] Bei der Roush-Reaktion fällt allerdings der große Boronat-Rest des Crotylboronates als Abfall an, sodass diese Synthesemethode aus Sicht der Atomökonomie nicht unbedingt empfehlenswert ist.
Anwendungsbeispiele
Die Roush-Reaktion wird häufig in der Synthese von asymmetrischen Verbindungen eingesetzt.[1] Ein Beispiel dafür ist die Herstellung von Stevastelin B, einem Depsipeptid mit immunsuppressiven Effekten, die auf den Japaner Yukio Yamamoto und Kollegen zurückgeht.[6] Die in diesem Artikel vorgestellte Reaktion wird zusammen mit einer ähnlichen Reaktion, der Evans-Aldol-Reaktion, angewendet, um Stereozentren zu synthetisieren.[1][3]

Einzelnachweise
- Z. Wang: Comprehensive Organic Name Reactions and Reagents. Volume 3, John Wiley & Sons, Hoboken 2009, ISBN 978-0-471-70450-8, S. 2435–2438.
- W. R. Roush, A. E. Walts, L. K. Hoong: Diastereo- and enantioselective aldehyde addition reactions of 2-allyl-1,3,2-dioxaborolane-4,5-dicarboxylic esters, a useful class of tartrate ester modified allylboronates. In: Journal of the American Chemical Society. Band 107, Nr. 26, 1985, S. 8186–8190, doi:10.1021/ja00312a062.
- L. Kürti, B. Czakó: Strategic Applications of Named Reactions in Organic Synthesis. Elsevier Academic Press, Burlington/ San Diego/ London 2005, ISBN 0-12-369483-3, S. 386–387.
- S. Kubik: Eintrag zu Homoallyl-Stellung. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. August 2017.
- B. M. Trost: The atom economy – a search for synthetic efficiency. In: Science. Band 254, Nr. 5037, 1991, S. 1471–1477, doi:10.1126/science.1962206.
- N. Kohyama, Y. Yamamoto: Total Synthesis of Stevastelin B, a Novel Immunosuppressant. In: Synlett. Band 2001, Nr. 5, 2001, S. 694–696, doi:10.1055/s-2001-13382.