Rothemund-Reaktion
Die Rothemund-Reaktion (auch Rothemund-Synthese genannt) ist eine Namensreaktion der organischen Chemie, die erstmals 1936 von Paul Rothemund beschrieben wurde. Mit Hilfe dieser Synthese lassen sich meso-substituierte Porphyrine herstellen.[1]
Übersichtsreaktion
Bei der Rothemund-Reaktion reagieren vier Äquivalente Pyrrol 1 mit vier Äquivalenten eines Aldehyds 2 mit Hilfe einer Säure (Salzsäure wurde von Rothemund genutzt) als Katalysator und anschließender Oxidation zu dem in α-,β-,γ- und δ-Position meso-substituierten Porphyrinderivat 3.[2]
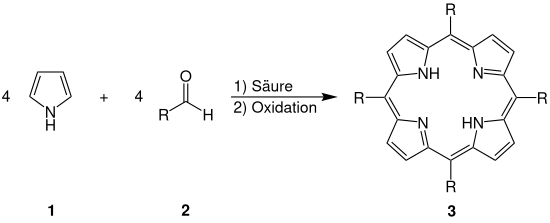
Allgemein
Die Rothemund-Reaktion ebnete den Weg für die Synthese vieler verschiedener Porphyrine.[3] Das Team um Rothemund hatte bereits bei 25 verschiedenen aliphatischen, aromatischen und heterocyclischen Aldehyden positive Ergebnisse bei der Synthese von Porphyrinen erhalten. Für die Reaktion wird Pyrrol benötigt, sowie Salzsäure als Katalysator. Als Lösungsmittel wurde Methanol genutzt. Die Reaktion findet in einem Zeitraum von 24 Stunden bei 140–150 °C statt.[2][4] Die Synthese wurde noch einmal von dem Team um Alan D. Adler 1964 modifiziert.[5] 1987 wurde das Verfahren ein weiteres Mal durch Jonathan S. Lindsey und andere verbessert.[6]
Reaktionsmechanismus
Im ersten Schritt wird der Aldehyd 1 im sauren Milieu protoniert und nucleophil durch das Pyrrol 2 angegriffen. Der entstehende Alkohol 3 wird protoniert und es wird Wasser abgespalten. Als nächstes kommt es erneut zum nucleophilen Angriff durch ein Pyrrol-Molekül und es bildet sich das Intermediat Dipyrromethan 4.[7][8]
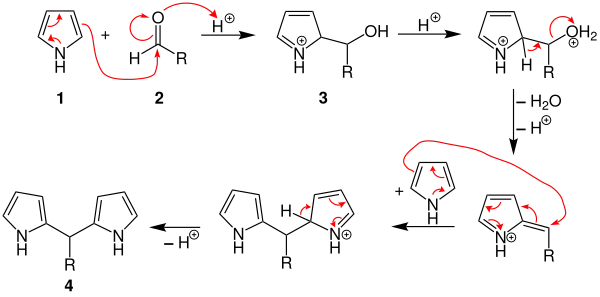
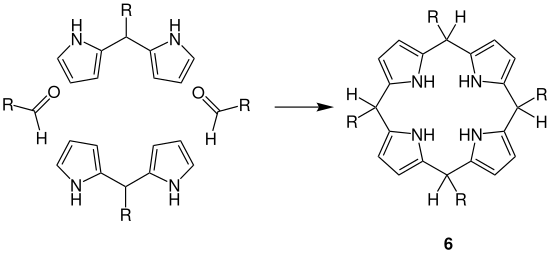
Wie es nach der Bildung des Dipyrromethan weitergeht, ist umstritten. Zwei Möglichkeiten werden im Nachfolgenden dargestellt. Das Dipyrromethan reagiert gemäß dem oben beschriebenen Reaktionsmechanismus zum Tetrapyrromethanderivat 5 weiter. Danach kommt es zu einem intramolekularen nucleophilen Angriff und damit zur Cyclisierung. Hierbei entsteht das Porphyrinogenderivat 6.

Eine andere Möglichkeit wäre, dass zwei Äquivalente Dipyrromethan zusammen mit zwei Äquivalenten des verwendeten Aldehyds zum Porphyrinogenderivat 6 weiterreagieren.
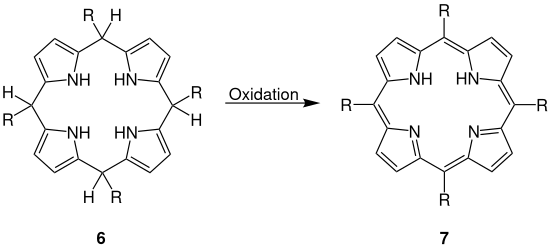
Durch Oxidation des Porphyrinogenderivat 6 entsteht als Produkt das Porphyrinderivat 7.
Anwendung
Die geringe Ausbeute von weniger als 5 % bei der Herstellung von Porphyrinen mit Hilfe dieser Methode ist der Grund dafür, dass sich dieses Verfahren, wie es von Rothemund beschrieben wurde, nicht für die industrielle Anwendung eignet. Das Team um Adler konnte mit leichten Modifikationen ca. 20 % Ausbeute erhalten. Mit noch weiteren Modifikationen gelang es ihnen sogar 35–40 % Ausbeute zu erhalten, jedoch war das Produkt bei dieser Methode verunreinigt. Dem Team um Lindsey (Rothemund-Lindsey-Reaktion) gelang es noch höhere Ausbeuten insbesondere für das Tetraphenylporphyrin zu erhalten. Porphyrine werden u. a. in der Medizin, als Bausteine für Materialien und die biomedizinische Forschung, sowie für Enzymmodelle und in Sensoren genutzt.[3][6][9]
Einzelnachweise
- Paul Rothemund: Formation of Porphyrins form Pyrrole and Aldehydes. In: Journal of the American Chemical Society. Band 57, Nr. 10, 1935, S. 2010–2011, doi:10.1021/ja01313a510.
- Paul Rothemund: A New Porphyrin Synthesis. The Synthesis of Porphin. In: Journal of the American Chemical Society. Band 58, Nr. 4, 1936, S. 625–627, doi:10.1021/ja01295a027.
- Chi K. Chang: Paul Rothemund and S. Ferguson MacDonald, and their Namesake Reactions – The Influence of the Fischer School on my Life in Porphyrin Chemistry. In: Israel Journal of Chemistry. Band 56, Nr. 2-3, August 2015, doi:10.1002/ijch.201500043.
- Paul Rothemund: Porphyrin Studies. III. The Structure of the Porphine Ring System. In: Journal of the American Chemical Society. Band 61, Nr. 10, 1939, S. 2912–2915, doi:10.1021/ja01265a096.
- Alan D. Adler, Frederick R. Longo, John D. Finarelli, Joel Goldmacher, Jacques Assour, and Leonard Korsakoff: A simplified synthesis for meso-tetraphenylporphine. In: The Journal of Organic Chemistry. Band 32, Nr. 2, 1967, S. 476–476, doi:10.1021/jo01288a053.
- Jonathan S. Lindsey, Irwin C. Schreiman, Henry C. Hsu, Patrick C. Kearney, and Anne M. Marguerettaz: Rothemund and Adler-Longo reactions revisited: synthesis of tetraphenylporphyrins under equilibrium conditions. In: The Journal of Organic Chemistry. Band 52, Nr. 5, 1987, S. 827–836, doi:10.1021/jo00381a022.
- Kurt Peter C. Vollhardt, Neil E. Schore: Organische Chemie. Hrsg.: Eugen Müller. 5. Auflage. Wiley-VCH, Weinheim 2011, ISBN 978-3-527-32754-6, doi:10.1002/3527682902.
- Joydev K. Laha,Savithri Dhanalekshmi,Masahiko Taniguchi,Arounaguiry Ambroise, and, and Jonathan S. Lindsey: A Scalable Synthesis of Meso-Substituted Dipyrromethanes. In: Organic Process Research & Development. Band 7, Nr. 6, 2003, S. 799–812, doi:10.1021/op034083q.
- David Dolphin: The Porphyrins: Structure and Synthesis. Nr. 1. Academic Press, Inc., New York 1978, ISBN 978-0-12-220101-1, S. 89–90, doi:10.1016/B978-0-12-220101-1.X5001-X.