Retigabin
Retigabin ist ein Arzneistoff mit krampflösender Wirkung. Im März 2011 wurde Retigabin unter dem Handelsnamen Trobalt EU-weit zugelassen zur Zusatztherapie bei fokalen Krampfanfälle bei Patienten mit Epilepsie, bei denen andere Kombinationen mit anderen geeigneten Arzneimitteln unzureichend wirkten oder nicht vertragen wurden.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
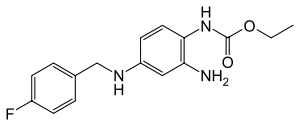 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Retigabin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C16H18FN3O2 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
N03AX21 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus |
KCNQ2/3-Öffner | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 303 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Trobalt wurde in Zusammenarbeit von dem US-amerikanischen Pharmaunternehmen Valeant Pharmaceuticals International und dem britischen Pharmaunternehmen GlaxoSmithKline entwickelt. 2017 wurde es weltweit vom Markt genommen[2]
Pharmakologie
Eigenschaften
Retigabin hat eine Plasmaproteinbindung von 80 %. Die Plasmahalbwertszeit beträgt 7,4–9,2 h, arzneilich wird das Dihydrochlorid verwendet. Die Applikation erfolgt oral. Strukturell und funktionell eng verwandt ist es mit dem seit 2018 aufgrund des hepatotoxischen Potentials nicht mehr zugelassenen Schmerzmittels Flupirtin.
Wirkmechanismus
Durch Retigabin erfolgt eine hochspezifische Aktivierung der spannungsabhängigen Kaliumkanäle KCNQ2/KCNQ3 vom M-Typ im Gehirn. Untereinheiten dieser Kanäle sind für die selektive Steuerung der Erregbarkeit von Nervenzellen verantwortlich. Eine Aktivierung wirkt sowohl antikonvulsiv, als auch gegen die Parkinson-Krankheit und neuroprotektiv. Bei einer Mutation dieser Kalium-Kanäle ist die Impulsweiterleitung im Gehirn gestört. Retigabin öffnet diese Kanäle und stabilisiert so die depolarisierten Nervenzellen.
An GABAA-Rezeptortypen mit Delta-Untereinheiten verstärkt es die Wirkung des Neurotransmitters GABA, was zusätzlich zur antikonvulsiven Wirkung beiträgt.[3]
Nebenwirkungen
In amerikanischen Postmarketing-Studien stellte sich heraus, dass Retigabin bei 6,3 % der Teilnehmer der ehemaligen Zulassungsstudie bei Langzeiteinnahme zu einer Blaufärbung der Haut führte, vorwiegend im Bereich der Lippen und Nägel. Derzeit ist noch unbekannt, ob die Verfärbung reversibel ist. Die betroffenen Patienten hatten das Medikament im Durchschnitt über mehr als vier Jahre eingenommen. Zudem kann es zu einer Pigmentstörung der Retina kommen, die auch eine möglicherweise irreversible Sehschärfeminderung mit sich bringen kann.[4]
Zulassung als Medikament
Im März 2011 wurde Retigabin unter dem Handelsnamen Trobalt EU-weit zugelassen. In Deutschland kam der Gemeinsame Bundesausschuss (G-BA) im Mai 2012 zu der Einschätzung, dass Retigabin trotz deutlicher Wirkung bei einem Teil der Patienten insgesamt keinen Zusatznutzen gegenüber den Vergleichssubstanzen Lamotrigin und Topiramat hat. Die Firma GlaxoSmithKline kündigte daraufhin an, das Medikament zunächst in Deutschland vom Markt zu nehmen.[5] 2017 erfolgte dies weltweit.
Therapeutisches Drug Monitoring (TDM)
Retigabin wird oral angewendet und besitzt eine durch fettreiche Nahrung beeinflussbare Resorption bei allgemein geringer Bioverfügbarkeit. Zusammen mit seiner schnellen Kinetik erschwert dies die Einstellung stabiler Wirkspiegel. Aufgrund von Nebenwirkungen ist eine Überdosierung zu vermeiden. Retigabin muss daher bei jedem Patienten individuell schrittweise aufdosiert werden. Daher ist die Durchführung eines TDM empfehlenswert.[6]
Literatur
- G. L. Plosker, L. J. Scott: Retigabin. In partial seizures. In: CNS drug review, 2006, 20, S. 601–608.
- G. Blackburn-Munro, W. Dalby-Brown, N. R. Mirza, J. D. Mikkelsen, R. E. Blackburn-Munro: Retigabin. Chemical synthesis to clinical application. In: CNS drug review, 2005, 11, S. 1–20.
- Use of Retigabin for treating neuropathic pain. Patenteintrag WO/2001/022953 bei Wipo.int.
- C. Runfeldt, R. Bartsch, A. Rostock, C. Tober, R. Dost: Use of Retigabin for treating neuropathic pain. In: WIPO, 2001, 1–7.
- G. Dannhard, W. Kiefer: Neue Antiepileptika in der Entwicklung. Substanzen mit neuen Wirkmechanismen. In: Pharmazie in unserer Zeit, 2007, 36/4, S. 306–310.
- T. V. Wuttke: Charakterisierung des molekularen Wirkmechanismus des neuen Antikonvulsivums Retigabin am KCNQ2-Kaliumkanal. (Abstract) Dissertation, Universität Ulm, 2006.
- Neue Arzneimittel: Trobalt® (Retigabin) (PDF; 287 kB) Information der Arzneimittelkommission der deutschen Ärzteschaft, 30. Mai 2011
Einzelnachweise
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von Carbamic acid, N-[2-amino-4-[[(4-fluorophenyl)methyl]amino]phenyl]-, ethyl ester im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 11. Juli 2020.
- deutsche-apotheker-zeitung.de
- M. Treven, X. Koenig, E. Assadpour, E. Gantumur, C. Meyer, K. Hilber, S. Boehm, H. Kubista: The anticonvulsant retigabine is a subtype selective modulator of GABAA receptors. In: Epilepsia. Band 56, Nummer 4, April 2015, S. 647–657, doi:10.1111/epi.12950, PMID 25779225, PMC 4949651 (freier Volltext).
- Potiga (Ezogabine): Drug Safety Communication - Linked To Retinal Abnormalities And Blue Skin Discoloration. Meldung der FDA vom 26. April 2013.
- Frank A. Miltner: Epilepsie: Medikament mit innovativem Wirkmechanismus (Retigabin) "ohne Zusatznutzen" eingestuft. Deutsche Gesellschaft für Neurologie, Pressemitteilung vom 4. Juni 2012 beim Informationsdienst Wissenschaft (idw-online.de), abgerufen am 24. August 2015.
- Analysen-Spektrum Retigabin. (Memento des Originals vom 10. Dezember 2015 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. labor-lademannbogen.de, Stand 26. April 2013.