RACE-PCR
Als RACE oder RACE-PCR (englisch rapid amplification of cDNA-ends und polymerase chain reaction) wird in der Molekularbiologie eine Kombination von Methoden zur schnellen Vervielfältigung von cDNA-Enden mit Hilfe der Polymerase-Kettenreaktion bezeichnet.
Eine RACE-PCR ist zumeist eine Form bzw. eine Abwandlung der RT-PCR, mit der die Enden von Genen erfasst werden können. Ein Ziel der RACE besteht oft in der Erfassung eines Gens als Locus im Genom (als Abschnitt im Erbgut). Während die Start- und Endpunkte der codierenden Sequenz von Genen meist durch die DNA-Sequenz selbst erkennbar sind (z. B. mit Hilfe von offenen Leserahmen), lassen sich die untranslatierten Regionen (UTRs) an den beiden Enden eines Gens nicht direkt aus der Genomsequenz ableiten. Die untranslatierten Regionen enthalten jedoch wichtige regulatorische Elemente, die die Translation der mRNA und deren Stabilität beeinflussen und sind daher von großem Interesse.[1][2][3]
Methoden
Durch RACE-PCR lässt sich die Sequenz der untranslatierten Bereiche einer mRNA ermitteln. Ausgehend von einer kurzen bekannten Sequenz, z. B. in der codierenden Region des Transkripts, kann das 5'-Ende (5'-RACE-PCR) oder 3'-Ende (3'-RACE-PCR) der mRNA untersucht werden. Bei Eukaryoten besitzen mRNA-Moleküle einen poly(A)-Schwanz, der als Ausgangspunkt für die 3'-RACE genutzt werden kann. Für die 5'-RACE muss an das 5'-Ende der mRNA eine zusätzliche Sequenz angebracht werden, z. B. durch Ligation eines Adapters. Sowohl die 3'- als auch die 5'-RACE-PCR basiert auf cDNA-Synthese und der Amplifikation von cDNA Fragmenten mittels PCR. Die Anwendung der Methode wird umso anspruchsvoller, je länger die noch zu bestimmende Sequenz ist, wodurch bspw. Unterschiede bei der Isolation eines 3'-UTR gegenüber dem 5'-UTR bestehen können.[2]
3'-RACE
Bereits eine der ersten Veröffentlichungen über die Methode RACE (Frohman et al., 1988)[4] basiert auf der Idee, die Polyadenylierung, die am 3'-Ende der mRNA eines jeden Gens bei Eukaryoten vorliegen sollte, als Bindungsort für einen kurzen DNA-Einzelstrang zu nutzen, der als Ausgangspunkt (Primer) für eine cDNA-Synthese dienen sollte. Der ursprünglich verwendete kurze DNA-Einzelstrang (adapter primer) hatte zwei Sequenzbereiche:
- einen Abschnitt mit 17 Thymin-Basen, um in einem ersten Schritt die Synthese von einzelsträngiger cDNA durch die komplementäre Basenpaarung zum Poly(A)-Schwanz der mRNA zu ermöglichen und
- einen zusätzlichen Abschnitt (mit 18 Basen), um in anschließenden Schritten eine PCR und die Klonierung zu gewährleisten.[4]
Die Schrittfolge der ursprünglichen Methode[4] verlief nach folgendem Schema:
- Ein speziell gestalteter adapter primer wird komplementär an den Poly(A)-Schwanz von mRNA gebunden.
- Durch eine reverse Transkriptase wird anhand des jeweiligen mRNA-Moleküls als Vorlage – ausgehend vom Primer – cDNA polymerisiert, sodass Doppelstrang-Moleküle aus mRNA und cDNA entstehen.
- Mit einem genspezifischen Primer (3'amp), welcher an der im vorhergehenden Schritt entstandenen cDNA binden kann und mit dem adapter primer wird eine PCR durchgeführt.
- Das PCR-Produkt, welches nun aus Molekülen von doppelsträngiger cDNA mit definierten Enden besteht, kann je nach Zielsetzung weiterverwendet werden, z. B. für eine Klonierung mit anschließender Sequenzierung.
Das methodische Schema dieser ursprünglichen 3'-RACE-Variante[4] wurde zwar in den Grundzügen beibehalten, erfuhr aber im Laufe der Zeit weitreichende Verbesserungen in den Details.[5] So wurde bspw. die Anwendung eines Primers vorgeschlagen [lock-docking oligo(dT) primer], der möglichst genau am Übergang vom 3'-Ende des transkribierten Teils der mRNA zum Poly(A)-Schwanz binden soll (also am 3'-Ende vom 3'-UTR) und nicht beliebig innerhalb des Poly(A)-Schwanzes.[6] Weiterhin wurde herausgefunden, dass zwei aufeinanderfolgenden PCR-Serien, bei denen unterschiedliche, „verschachtelte“ Primer (nested primers) verwendet werden, die Spezifität in Bezug auf das gesuchte Gen steigern können.[5][7] Dagegen führte bei der Methode, die dortselbst als „klassische 3'-RACE“ bezeichnet wurde,[5] ein zusätzlicher Schritt für den Abbau der RNA (durch Hydrolyse oder durch die Enzyme RNase H und RNase A) nur selten zu einer Verbesserung bei der anschließenden cDNA-Amplifikation durch PCR.
 Siehe nebenstehender Text. Das Schema der Methode wird hier in sechs Schritten skizziert (links; I. bis VI.), während die Bildelemente (sämtlich Nukleinsäure-Moleküle) mit (a) bis (n) gekennzeichnet wurden (rechts; Legende). I. An der zuvor aus Zellen von Eukaryoten isolierten RNA (Gesamt-RNA oder mRNA) wird eine spezieller Primer an den Polyadenylierungen gebunden, welche an den mRNA-Molekülen vorhanden sind. Dargestellt ist ein einzelnes mRNA-Molekül (a) des zu untersuchenden Gens, das aus dem transkribierten Teil (b) und einer Polyadenylierung (c) am 3‘-Ende besteht. Irgendwo innerhalb des Poly(A)-Schwanzes kann eine spezieller Primer binden, der zumeist Ankerprimer (d) genannt wird. Der Ankerprimer hat zwei Bereiche, eine Oligo(dT)-Sequenz (e), die komplementär am Poly(A)-Schwanz bindet (hier ungefähr in der Mitte) und eine Adapter-Sequenz (f), die erst einmal nicht bindet und später gebraucht wird. II. Mithilfe einer Reversen Transkriptase wird der Ankerprimer (d) durch cDNA-Synthese verlängert (im Bild auf der Seite der Pfeilspitze, am 3‘-Ende des Primers, von rechts nach links). Die anfänglich erzeugte DNA steht nicht im Fokus (g), da es sich lediglich um eine Poly(dT)-Sequenz handelt, die komplementär zum Poly(A)-Schwanz gebildet wird. Nachdem die Reverse Transkriptase das 3‘-Ende vom Gen, die Polyadenylierungsstelle, erreicht hat, wird durch die Reverse Transkriptase genspezifische cDNA (h) gebildet, wobei die Synthese der Erststrang-cDNA in Antisense-Richtung verläuft (i). III. Nach der Erststrang-cDNA-Synthese liegen mRNA/cDNA-Hybridmoleküle vor, die voneinander getrennt werden müssen. Das kann unmittelbar durch die anschließende Polymerasekettenreaktion (PCR) erfolgen. Als erstes kann ein genspezifischer Primer (k) binden, der aus einem bereits bekannten Abschnitt des gesuchten Gens abgeleitet wurde. IV. Im ersten Verlängerungsschritt der ersten PCR (Elongation) sollten möglichst nur die Erststrang-cDNA-Moleküle zum cDNA-Doppelstrang ergänzt werden, die zum genspezifischen Primer (k) passen. Andere DNA-Moleküle, z. B. zu kurze und diejenigen, welche zu anderen Genen gehören, sollten unberücksichtigt bleiben. V. Die doppelsträngige DNA kann durch zwei Primer, einen genspezifischen (k) und einen Adapter-Sequenz-Primer (m) amplifiziert werden. VI. Da die PCR mit nur einem genspezifischen Primer mehr unerwünschte Produkte erzeugt, als das bei einer herkömmlichen PCR mit zwei genspezifischen Primern der Fall wäre, wird eine zweite PCR mit neuen, „verschachtelten Primern“ durchgeführt, die ebenfalls genspezifisch (l) und entsprechend der Adapter-Sequenz (n) binden. Sie liegen innerhalb des zuvor hergestellten PCR-Produkts. Das zweite, etwas kürzere PCR-Produkt beinhaltet in der verbliebenen Adaptersequenz Endorestriktase-Schnittstellen, die sich gut für eine Klonierung des RACE-PCR-Produkts eignen. |
5'-RACE
Während bei einer 3'-RACE die Polyadenylierung, die sich bei Eukaryoten am 3'-Ende von mRNA-Molekülen befindet, für die Einleitung der Synthese eines cDNA-Strangs genutzt werden kann, ist eine solche Struktur am 5'-Ende nicht vorhanden. Um beide Enden eines Gens auf ähnliche Weise untersuchen zu können, wurde schon bei den ersten 5'-RACE-Anwendungen (Frohman et al., 1988)[4] eine künstlich Polyadenylierung erzeugt.
Die Schrittfolge der ursprünglichen Methode[4] verlief nach folgendem Schema:
- Ein genspezifischer Primer (5RT), der eine reverse Transkription hin zum 5'-Ende des gesuchten Gens ermöglichen soll (in Antisense-Richtung), wird an die RNA gebunden.
- Durch eine Reverse Transkriptase wird anhand des jeweiligen mRNA-Moleküls als Vorlage – ausgehend vom Primer – cDNA polymerisiert, sodass Doppelstrang-Moleküle aus mRNA und cDNA entstehen.
- Überschüssiger Primer wird durch ein Reinigungsverfahren entfernt.
- Mithilfe eines Enzyms, einer Terminalen Desoxynukleotidyl-Transferase, wird die zuvor entstandene einzelsträngige cDNA an ihrem 3'-Ende (welches dem 5'-Ende des Gens entspricht) polyadenyliert, d. h., um eine Reihe von Nukleotiden mit der Base Adenin verlängert.
- Mit einem speziellen Primer, dem (dT)17-adaptor primer, wird der zweite cDNA-Strang synthetisiert und die folgende Amplifikation eingeleitet. Der Primer kann am künstlich polydadenylierten cDNA-Ende binden und beinhaltet eine Adaptorsequenz.
- Mit einem genspezifischen Primer (5'amp) und mit einem adapter primer wird die Amplifikation der cDNA durch PCR vorgenommen.
- Das PCR-Produkt, welches nun aus Molekülen von doppelsträngiger cDNA mit definierten Enden besteht, kann je nach Zielsetzung weiterverwendet werden, z. B. für eine Klonierung mit anschließender Sequenzierung.
Dieses ursprüngliche Konzept der 5'-RACE,[4] bei welchem eine Terminale Desoxynukleotidyl-Transferase (TdT) eingesetzt wird, um einen Anker als Ausgangspunkt für die Synthese des zweiten cDNA-Stranges zu erhalten, wurde auch „klassische 5'-RACE“ genannt und innerhalb dieser Rahmenbedingungen weiterentwickelt.[5][8] Es gab Anstrengungen, diese „klassische 5'-RACE“ zu optimieren, z. B. indem der Anker nicht aus Adenin, sondern durch Cytosin als sich wiederholende Base gebildet wurde.[9] Die komplementäre Bindung eines Oligo-(dG)-Primers an einem Poly(dC)-Anker ist stärker, als es die Bindung eines Oligo-(dT)-Primers an einem Poly(dA)-Anker wäre, was mitunter Vorteile mit sich bringen kann;[9] darüber hinaus kann die Bindungsstärke angepasst werden, indem der Primer nicht nur die üblichen dG-Bausteine (Desoxyguanosinmonophosphat), sondern auch dI-Bausteine (Desoxyinosinmonophosphat) enthält.[10] Vor dem Einsatz der Terminalen Desoxynukleotidyl-Transferase (TdT) wurde eine RNAse-Behandlung empfohlen.[11]
Andere Überlegungen zur 5'-RACE beinhalteten die Nutzung der bei Eukaryoten am 5'-Ende vom mRNA vorhandenen Cap-Struktur. Diese Struktur kann genutzt werden, um eine Ankersequenz an der mRNA zu ligieren (siehe Abschnitte #RLM-RACE und #Oligo-capping) oder um eine Reverse Transkriptase zu veranlassen, die Synthese der cDNA über das 5'-Ende der mRNA hinaus fortzusetzen (siehe Abschnitt #SMART-RACE). Weiterhin können Nukleinsäure-Moleküle zum Ring geschlossen werden, sodass die Notwendigkeit einer zusätzlichen Struktur am jeweiligen Ende des verwendeten Makromoleküls entfällt (siehe Abschnitt #cRACE).
RLM-RACE
Bei der RLM-RACE (RNA ligase mediated RACE) werden durch eine entsprechende Ligase Einzelstränge von Nukleinsäuren zusammen gefügt.[12] Die Methode dient zur Untersuchung von Gen-Enden. In der Original-Arbeit[12] wurden zwei Varianten vorgestellt; eine für das 3'-Ende des jeweiligen Gens und eine für das 5'-Ende. Im Folgenden wird die Variante für das 5'-Ende dargestellt:[12]
- Die 5'-Cap-Struktur der mRNA wird chemisch unter Verwendung von Natriumperiodat entfernt (die Methode basiert auf[13]). Anschließend enthält die mRNA an den 5'-Enden mehr als eine Phosphat-Gruppe und wird deshalb durch Alkalische Phosphatase (calf intestine phosphatase, CIP) dephosphoryliert. Da im Weiteren für die Ligation genau eine Phosphat-Gruppe am jeweiligen 5'-Ende der mRNA benötigt wird, kommt eine Kinase zur Anwendung (T4-Polynukleotidkinase). Mit Hilfe der T4-RNA-Ligase werden kurze, in ihrer Sequenz einheitliche RNA-Oligonukleotide an die 5'-Enden der mRNA-Moleküle gefügt. (In der Original-Arbeit[12] entstammten die kurzen, in ihrer Sequenz einheitlichen RNA-Oligonukleotiden einer zuvor durchgeführten Polymerase-Reaktion, bei der die T7-RNA-Polymease zum Einsatz kam.) Mit den veränderten mRNA-Molekülen wird nun eine cDNA-Synthese durchgeführt, indem kurze DNA-Oligonukleotide zufälliger Sequenz an die mRNA durch komplementäre Basenpaarung gebunden werden. Eine Reverse Transkriptase nutzt diese DNA-Oligonukleotide (Hexamere) als Primer, während sie das jeweilige mRNA-Molekül als Vorlage für die cDNA-Erststrang-Synthese verwendet. Die cDNA-Einzelstränge weisen an ihren 3'-Enden jeweils eine einheitliche Sequenz auf. (Diese einheitliche Sequenz geht auf die RNA-Ligation zurück, die zuvor mit den kurzen, in ihrer Sequenz einheitlichen RNA-Oligonukleotiden durchgeführt wurde.) Eine cDNA-Zweitstrang-Synthese ist nicht erforderlich; die PCR kann nun mit einem einheitlichen und einem Gen-spezifischen Primer erfolgen.
Oligo-capping
Das von K. Maruyama und S. Sugano 1994 vorgestellte Oligo-capping[14] ähnelt der RLM-RACE, die 1993 von X. Liu und M. A. Gorovsky beschrieben[12] wurde. In beiden Fällen werden an die 5'-Enden der RNA-Moleküle, die das biologische Untersuchungsmaterial darstellen, einheitliche, künstlich erzeugte RNA-Oligonukleotide ligiert, welche die 5'-Cap-Struktur ersetzen sollen. Unterschiede bestehen unter anderem in der Art der Entfernung der Cap-Struktur und in der Zahl und der Reihenfolge der Schritte.
Das Oligo-capping dient zur Untersuchung des vollständigen 5'-Endes der cDNA. Hierfür werden zuerst RNA-Bruchstücke, die freie 5' Phosphatenden tragen durch Alkalische Phosphatase (bacterial alkaline phosphatase, BAP) dephosphoryliert. Nur durch capping geschützte mRNAs sind hiervon nicht betroffen. Im zweiten Schritt werden die Caps mit Hilfe einer Nikotinsäure-Pyrophosphatase (tobacco acid pyrophosphatase, TAP) abgespalten, wobei das 5'-α-Phosphat erhalten bleibt. Mit Hilfe der T4-RNA-Ligase wird dann ein RNA-Adapter-Oligonukleotid mit bekannter Sequenz an die mRNA ligiert. Anschließend kann mit einem antisense Primer eine cDNA-Synthese durchgeführt werden. Darauf folgt eine PCR mit dem zur cDNA-Synthese genutzten Primer und dem am 5'-Ende angefügten Adapter-Primer.
SMART-RACE
Die Bezeichnung SMART™ (switching mechanism at 5' end of RNA transcript) ist ein zuerst von Clontech Laboratories (Inc.) genutzter Handelsname.[15][16] Der Vorläufer von SMART™ war CapFinder™.[17] Heute werden SMART-Produkte, z. B. das "SMART® cDNA Library Construction Kit",[18] von Takara Bio (Inc.) vertrieben.
Bei der SMART-RACE wird die gesamte mRNA von einem Oligo(dT)-Primer ausgehend in cDNA umgeschrieben. Die Reverse Transkriptase hängt an das 3'-Ende der cDNA gegenüber der CAP-Struktur (entspricht dem 5'-Ende der mRNA) eine kurze Oligo(dC)-Sequenz an, die vorerst nicht komplementär gepaart ist. Mit Hilfe eines weiteren Ankerprimers, der eine passende Oligo(dG)-Struktur für eine komplementäre Paarung aufweist, kann die Reverse Transkriptase den cDNA-Strang verlängern, indem sie von der mRNA als Vorlage zum Ankerprimer wechselt. Der cDNA-Einzelstrang, der nun vorliegt, hat durch die verwendeten Ankerprimer an beiden Enden spezifische Sequenzen, die sich für eine RACE-PCR eignen, die anschließend durchgeführt wird. Die weitere Untersuchung verläuft analog zu den anderen RACE-Methoden.
cRACE
Die cRACE ist eine 5'-RACE-Methode, bei der die beiden Enden der anfangs synthetisierten cDNA miteinander ligiert werden, sodass ein zirkuläres cDNA-Molekül entsteht (Maruyama et al., 1995).[19] Die Abkürzung basiert auf der Benennung als: „durch zirkuläre bzw. verknüpfte Erststrang-cDNA vermittelte RACE“ (circular or concatemeric first-strand cDNA-mediated RACE).[19] Die Schrittfolge dieser Methode[19] verläuft nach folgendem Schema:
- Ein genspezifischer Primer wird am 5'-Ende durch das Enzym T4-Polynukleotidkinase phosphoryliert.
- Mithilfe des genspezifischen, 5'-phosphorylieren Primers (der an mRNA gebunden wird) und mithilfe einer Reversen Transkriptase wird die Erststrang-cDNA synthetisiert.
- Die RNA wird durch alkalische Hydrolyse entfernt und die (genspezifische) Einzelstrang-cDNA wird gefällt (Ethanol).
- Die Einzelstrang-cDNA wird in Lösung gebracht und durch das Enzym T4-RNA-Ligase an den Enden verknüpft.
- Mit zwei weiteren genspezifischen Primern, die stromaufwärts (upstream) des zuerst eingesetzten Primers binden können und sich für die Amplifikation aus zirkulären cDNA-Molekülen eignen, wird eine PCR durchgeführt.
Einer der größten Vorteile gegenüber anderen RACE-Varianten ist möglicherweise, dass keine Ankerprimer oder Ähnliches, sondern nur genspezifische Primer für alle Schritte verwendet werden.[19] Die Idee, einzelsträngige cDNA zu zirkularisieren,[19] gründet auf einer zuvor entwickelten Methode (Mandl et al., 1991),[20] bei der mRNA-Moleküle (die zuvor aufwändig behandelt werden mussten) an den beiden Enden verknüpft wurden.
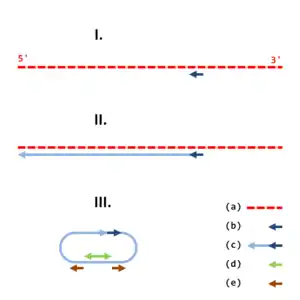 Siehe nebenstehender Text. I. Ein genspezifischer Primer (b) bindet spezifisch an einem mRNA-Molekül (a). II. Der Primer wird durch die Synthese der Erststrang-cDNA (c) verlängert. III. Die einzelsträngige cDNA wird nach Beseitigung der RNA mit sich selbst ligiert, sodass eine Ring-Molekül entsteht. Mithilfe verschiedener genspezifischer Primer können anschließend verschachtelte Polymerasekettenreaktionen (PCR) für die Amplifikation des gesuchten Genabschnitts durchgeführt werden. Es sind mögliche Positionen für die Primer der ersten PCR (d) und für die Primer der zweiten PCR (e) eingezeichnet. |
Siehe auch
Literatur
- M. A. Frohman, M. K. Dush, G. R. Martin: Rapid production of full-length cDNAs from rare transcripts: amplification using a single gene-specific oligonucleotide primer. In: Proceedings of the National Academy of Sciences. Band 85, Nr. 23, 1. Dezember 1988, ISSN 0027-8424, S. 8998–9002, doi:10.1073/pnas.85.23.8998, PMID 2461560, PMC 282649 (freier Volltext) – (englisch).
- M. A. Frohman: Rapid amplification of complementary DNA ends for generation of full-length complementary DNAs: thermal RACE. In: Methods Enzymol. Band 218, 1993, S. 340–356, PMID 7685466.
Einzelnachweise
- Pickering, B.M. & Willis, A.E. (2004): The implications of structured 5' untranslated regions on translation and disease. In: Semin Cell Dev Biol. Bd. 16, S. 39–47. PMID 15659338.
- Mazumder, B. et al. (2003): Translational control by the 3'-UTR: the ends specify the means. In: Trends Biochem. Sci. Bd. 28, S. 91–98. PMID 12575997 doi:10.1016/S0968-0004(03)00002-1.
- Scotto–Lavino E., Du G. & Frohman M.A. (2007): 3' End cDNA amplification using classic RACE In: Nature Protocols. Bd. 1, S. 2742–2745 doi:10.1038/nprot.2006.481.
- M. A. Frohman, M. K. Dush, G. R. Martin: Rapid production of full-length cDNAs from rare transcripts: amplification using a single gene-specific oligonucleotide primer. In: Proceedings of the National Academy of Sciences of the United States of America. Band 85, Nr. 23, Dezember 1988, ISSN 0027-8424, S. 8998–9002, doi:10.1073/pnas.85.23.8998, PMID 2461560, PMC 282649 (freier Volltext).
- M. A. Frohman: On beyond classic RACE (rapid amplification of cDNA ends). In: PCR methods and applications. Band 4, Nr. 1, August 1994, ISSN 1054-9803, S. S40–58, doi:10.1101/gr.4.1.s40, PMID 9018326.
- N. D. Borson, W. L. Salo, L. R. Drewes: A lock-docking oligo(dT) primer for 5' and 3' RACE PCR. In: PCR methods and applications. Band 2, Nr. 2, November 1992, ISSN 1054-9803, S. 144–148, doi:10.1101/gr.2.2.144, PMID 1477669.
- M.A. Frohman, G.R. Martin: Rapid amplification of cDNA ends using nested primers. In: Techniques. Band 1, 1989, S. 165–173.
- Anonym: Rapid amplification of 5′ complementary DNA ends (5′ RACE). In: Nature Methods. Band 2, Nr. 8, August 2005, ISSN 1548-7091, S. 629–630, doi:10.1038/nmeth0805-629.
- E.Y. Loh, J.F. Elliott, S. Cwirla, L.L. Lanier, M.M. Davis: Polymerase chain reaction with single-sided specificity: analysis of T cell receptor delta chain. In: Science (New York, N.Y.). Band 243, Nr. 4888, 13. Januar 1989, ISSN 0036-8075, S. 217–220, doi:10.1126/science.2463672, PMID 2463672.
- D.M. Schuster, G.W. Buchman, A. Rastchian: A simple and efficient method for amplification of cDNA ends using 5' RACE. In: Focus. Band 14, 1992, S. 46–52.
- 5´ RACE System for Rapid Amplification of cDNA Ends - US. In: Technical Reference Library. ThermoFisher SCIENTIFIC, 6. Dezember 2004, abgerufen am 12. Mai 2021 (englisch).
- Xiuwen Liu, Martin A. Gorovsky: Mapping the 5′ and 3′ ends of Tetrahymena thermophila mRNAs using RNA ligase mediated amplification of cDNA ends (RLM-RACE). In: Nucleic Acids Research. Band 21, Nr. 21, 1993, ISSN 0305-1048, S. 4954–4960, doi:10.1093/nar/21.21.4954, PMID 8177745, PMC 311412 (freier Volltext) – (englisch).
- Jay R. Greenberg, Virginia E. Burn: Proteins associated with rabbit reticulocyte mRNA caps during translation as investigated by photocrosslinking. In: Nucleic Acids Research. Band 16, Nr. 8, 1988, ISSN 0305-1048, S. 3437–3454, doi:10.1093/nar/16.8.3437, PMID 3131737, PMC 336504 (freier Volltext) – (englisch).
- K. Maruyama, S. Sugano: Oligo-capping: a simple method to replace the cap structure of eukaryotic mRNAs with oligoribonucleotides. In: Gene. Band 138, Nr. 1-2, 28. Januar 1994, ISSN 0378-1119, S. 171–174, doi:10.1016/0378-1119(94)90802-8, PMID 8125298.
- Clontech Laboratories: SMART™ cDNA Amplification Construction Kit. In: CLONTECHniques. Band 16, Nr. 4, Oktober 2001, S. 12–13 (englisch, ebiotrade.com [PDF; abgerufen am 13. Juni 2020]).
- Clontech Laboratories: SMART™ cDNA Amplification Construction Kit. In: CLONTECHniques. Band 14, Nr. 3, 1999, S. 4–7 (englisch).
- Clontech Laboratories: CapFinder™ PCR cDNA Library Construction Kit. In: CLONTECH (Hrsg.): CLONTECHniques. Band 11, Nr. 1, 1996, S. 2–4 (englisch).
- Takara Bio USA: SMART® cDNA Library Construction Kit User Manual. (PDF) Abgerufen am 13. Juni 2020 (PDF-Datei online).
- Ichiro N. Maruyama, Terese L. Rakow, Hiroko I. Maruyama: cRACE: a simple method for identification of the 5′ end of mRNAs. In: Nucleic Acids Research. Band 23, Nr. 18, 1995, ISSN 0305-1048, S. 3796–3797, doi:10.1093/nar/23.18.3796, PMID 7479016, PMC 307285 (freier Volltext).
- C. W. Mandl, F. X. Heinz, E. Puchhammer-Stöckl, C. Kunz: Sequencing the termini of capped viral RNA by 5'-3' ligation and PCR. In: BioTechniques. Band 10, Nr. 4, April 1991, ISSN 0736-6205, S. 484, 486, PMID 1651093.