Posttranslationaler Proteintransport
Posttranslationaler Proteintransport bezeichnet in der Zellbiologie Mechanismen, bei denen ein zuvor im Cytosol einer Zelle gebildetes Protein durch eine Membran transportiert wird, nachdem mit der Translation die Proteinbiosynthese am Ribosom abgeschlossen ist. In prokaryoten und in eukaryoten Zellen sind verschiedene Formen des posttranslationalen Proteintransports zu finden. Davon abzugrenzen sind Translokationen der (noch ungefalteten) Polypeptidkette eines Proteins in oder durch eine Membran, die schon während der Translation stattfinden und daher als cotranslationaler Proteintransport bezeichnet werden.
Eigenschaften
Posttranslationaler Proteintransport findet vor allem an Organellen wie Mitochondrien, Plastiden (und auch an deren Thylakoiden) und Peroxisomen sowie am Zellkern statt. Außerdem findet man posttranslationalen Proteintransport an der cytoplasmatischen Membran von Bakterien.
Eine weitere Form des posttranslationalen Transports findet man am endoplasmatischen Retikulum (ER), wo Proteine von der cytosolischen Seite durch die ER-Membran in das Lumen des ER transportiert werden.
Bei diesem Vorgang werden die Proteine vollständig im Cytoplasma synthetisiert und erst anschließend durch die ER-Membran transportiert. Der Großteil der heute vorhandenen Erkenntnisse über diese Form des ER-Transports stammt aus Untersuchungen, die an der Hefe Saccharomyces cerevisiae durchgeführt wurden. Die Signalsequenz eines Proteins bestimmt, ob ein sekretorisches Protein co- oder posttranslational in das ER transportiert wird. Bei hydrophileren Signalsequenzen scheint die Affinität des signal recognition particle (SRP) zur Signalsequenz geringer ausgeprägt zu sein, wodurch es zu keiner festen Bindung und somit zu keiner Translationspause kommt, die den cotranslationalen Transport einleiten würde. Das Protein wird vollständig im Cytoplasma synthetisiert und vom Ribosom abgelöst.
Um das Transportsubstrat in einem translokationskompetenten Zustand zu halten, binden cytosolische Chaperone der Hsp70-Familie an das Protein. Über den nachfolgenden Prozess der Zielleitung des Proteins zur ER-Membran ist wenig bekannt. Die gebundenen cytosolischen Faktoren scheinen jedoch für den eigentlichen Transport durch die ER-Membran keine essentielle Rolle zu spielen, da durch Harnstoff denaturierte (und somit von HSP70 befreite) Transportproteine in vitro genau so effizient posttranslational transportiert werden wie die nativen Proteine.
Rekonstitutionsexperimente mit aufgereinigten Komponenten aus Hefe-Mikrosomen zeigten, dass neben dem luminalen Chaperon Kar2p und ATP ein spezieller Membrankomplex benötigt wird, um in vitro posttranslational PräPro-a-Faktor zu transportieren. Bei diesem Komplex handelt es sich um den hetero-heptameren Sec-Komplex, der sich aus dem trimeren Sec61-Komplex und dem tetrameren Sec62/Sec63-Komplex zusammensetzt. Der Sec-Komplex bildet dabei, ähnlich wie das Ribosom mit dem Sec61-Komplex, ringförmige Strukturen in der Membran aus.
Der eigentliche posttranslationale Transport der Proteine durch die ER-Membran erfolgt in zwei Schritten. Zuerst bindet das zu transportierende Protein, Kar2p- und ATP-unabhängig an den Sec-Komplex, wobei die cytosolisch liegenden Komponenten des Sec62/Sec63-Subkomplexes wahrscheinlich eine Art Signalsequenz-Antenne in der Membran bilden. Durch Quervernetzungsstudien konnte gezeigt werden, dass die Signalsequenz des Proteins während dieser Phase von der großen Untereinheit des Sec61-Komplexes erkannt und gebunden wird. Im zweiten Schritt des Transportprozesses wird die gebundene Polypeptidkette wie beim cotranslationalen Transport durch den vom Sec61-Komplex gebildeten Kanal bewegt, wobei für einen effizienten Transport zusätzlich Kar2p und ATP benötigt werden. Beim Kar2p handelt es sich um ein Hsp70 homologes Protein, das sowohl in vivo als auch in vitro für den posttranslationalen Transport benötigt wird. Die ATP gebundene Form des Kar2p bindet an die im Lumen des ER liegende DnaJ homologe Domäne des Sec63p Proteins aus dem Sec62/63-Subkomplex und wird unter ATP-Hydrolyse mit geringer Sequenzspezifität auf die Polypeptidkette des zu translozierenden Proteins übertragen.
Für das Modellprotein PräPro-a-Faktor konnte in vitro gezeigt werden, dass der Transport durch die ER-Membran nach dem Prinzip einer molekularen Ratsche erfolgt. Das Transportsubstrat kann infolge der Brownsche Molekularbewegung im Translokonskanal frei in beide Richtungen diffundieren. Erst durch die Anlagerung des luminalen Kar2p an die Polypeptidkette entsteht ein gerichteter Transportprozess, da im Lumen befindliche Bereiche der Polypeptidkette durch das gebundene Kar2p nicht mehr in den Kanal zurückgleiten können. Durch das sukzessive Binden von weiteren Kar2p Proteinen an die Polypeptidkette erfolgt der Transport des Proteins ins Lumen des ER.
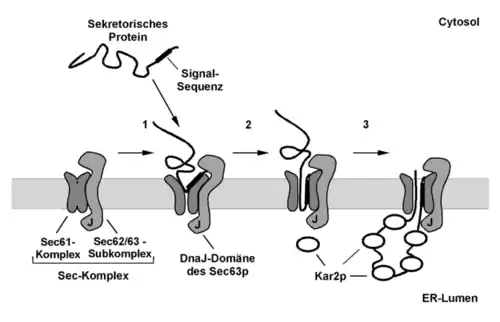
Modell des posttranslationalen Proteintransportes durch die ER-Membran der Hefe Saccharomyces cerevisiae.
- Das zu transportierende Protein wird vollständig im Cytoplasma synthetisiert und durch cytosolische Chaperone in einem translokationskompetenten Zustand gehalten. Die Signalsequenz des Proteins wird in einem ATP und Kar2p unabhängigen Schritt vom Sec-Komplex erkannt und gebunden.
- Der N-Terminus der Polypeptidkette inseriert vermutlich in Form einer Haarnadel in den vom Sec61-Subkomplex gebildeten Translokationskanal.
- Die eigentliche Translokation der Polypeptidkette durch die ER-Membran erfolgt in einem ATP- und Kar2p- abhängigen Prozess. Das luminal vorkommende Kar2p wird durch die DnaJ Domäne des Sec63p zur Bindung von Peptiden aktiviert. Sobald die zu transportierende Polypeptidkette auf der luminalen Seite der ER-Membran heraustritt, wird Kar2p unter ATP-Spaltung auf diese Bereiche übertragen, wodurch ein Zurückgleiten der Kette verhindert wird (molekulare Ratsche). Durch das sukzessive Binden von weiteren Kar2p-Proteinen wird die ungerichtete Brownsche Molekularbewegung der Polypeptidkette im Translokon in einen gerichteten Transportprozess umgewandelt.
Bakterielle Proteinsekretion muss bei Gram-negativen Bakterien auch noch die äußere Membran der Bakterien überwinden. Hierzu haben die Organismen mindestens fünf verschiedenen Systeme (Typ I bis Typ V) entwickelt.
Literatur
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemie. 6 Auflage, Spektrum Akademischer Verlag, Heidelberg 2007. ISBN 978-3-8274-1800-5.
- Donald Voet, Judith G. Voet: Biochemistry. 3. Auflage, John Wiley & Sons, New York 2004. ISBN 0-471-19350-X.
- Bruce Alberts, Alexander Johnson, Peter Walter, Julian Lewis, Martin Raff, Keith Roberts: Molecular Biology of the Cell, 5. Auflage, Taylor & Francis 2007, ISBN 978-0815341062.