Polysilazane
Polysilazane sind polymere Verbindungen, in denen Silicium- und Stickstoffatome in alternierender Anordnung das chemische Grundgerüst bilden. Häufig ist dabei jedes Siliciumatom an zwei Stickstoffatome gebunden und jedes Stickstoffatom an zwei Siliciumatome, so dass sich bevorzugt molekulare Ketten und Ringe der Formel [R1R2Si–NR3]n bilden. R1-R3 können dabei Wasserstoffatome oder organische Reste sein. Sind nur H-Atome als Substituenten vorhanden, bezeichnet man das Polymer als Perhydropolysilazan ([H2Si–NH]n, auch Polyperhydridosilazan, anorganisches Polysilazan). Sind Kohlenwasserstoffreste am Silicium gebunden, spricht man von Organopolysilazanen. In ihrer molekularen Struktur sind die Polysilazane [R1R2Si–NH]n eng verwandt mit den Polysiloxanen [R1R2Si–O]n (Silikone), mit denen sie isoelektronisch sind.
Geschichtliches
Die Synthese von Polyorganosilazanen wurde erstmals im Jahre 1964 von Krüger und Rochow beschrieben. Sie stellten zunächst durch Reaktion von Ammoniak mit Chlorsilanen (Ammonolyse) trimere oder tetramere Cyclosilazane her, die dann unter dem Einfluss eines Katalysators bei hohen Temperaturen zu hochmolekularen Polymeren reagieren. Die Ammonolyse von Chlorsilanen stellt bis heute die wichtigste Methode zur Synthese von (Poly-)Silazanen dar. Die großtechnische Herstellung von Chlorsilanen nach dem Müller-Rochow-Verfahren legte damit im Jahre 1940 auch den Grundstein für die Entwicklung der Silazanchemie. In den 1960er Jahren wurden erstmals Versuche zur Umwandlung von siliziumorganischen Polymeren in quasi-keramische Materialien beschrieben. Dabei wurden geeignete (so genannte präkeramische) Polymere auf ca. 1000 °C oder höher erhitzt, wodurch sich unter Abspaltung von organischen Gruppen und Wasserstoff sowie Umordnung der Atome zunächst amorphe anorganische Netzwerke ausbilden, die sowohl in chemischer als auch in physikalischer Sicht ein einzigartiges Eigenschaftsprofil aufweisen. Mit Hilfe der polymer-abgeleiteten Keramiken (engl. polymer-derived ceramic, PDC) können insbesondere im Bereich der Hochleistungsmaterialien neue Anwendungsgebiete erschlossen werden. Als wichtigste präkeramische Polymere sind Polysilane [R1R2Si–R1R2Si]n, Polycarbosilane [R1R2Si–CH2]n, Polysiloxane [R1R2Si–O]n und Polysilazane [R1R2Si–NR3]n zu nennen.
Struktur
Wie alle Polymere sind Polysilazane aus einer oder mehreren Grundeinheiten, den Monomeren, aufgebaut. Durch Aneinanderreihung dieser Grundeinheiten bilden sich unterschiedlich große Ketten, Ringe und dreidimensional vernetzte Makromoleküle mit einer mehr oder weniger breiten Molmassenverteilung. Die Monomereinheit dient auch zur Beschreibung der chemischen Zusammensetzung und der Verknüpfung der Atome (Koordinationssphäre), ohne jedoch Aussagen über die makromolekulare Struktur zu machen.
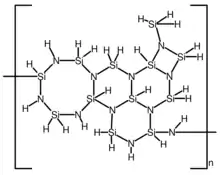
In Polysilazanen ist jedes Siliciumatom an zwei Stickstoffatome gebunden und jedes Stickstoffatom an mindestens zwei Siliciumatome (es können auch drei sein). Wenn alle übrigen Valenzen durch Wasserstoffatome abgesättigt sind, entsteht das Perhydropolysilazan [H2Si–NH]n, dessen idealisierte Struktur rechts abgebildet ist. Bei den Organopolysilazanen ist mindestens ein organischer Rest an das Silicium gebunden. Die Anzahl und Art der Reste hat wesentlichen Einfluss auf die makromolekulare Struktur dieser Polysilazane.
Silazan-Copolymere werden in der Regel durch Ammonolyse von Chlorsilan-Mischungen hergestellt. Bei dieser chemischen Umsetzung reagieren die unterschiedlichen Chlorsilane meist ähnlich schnell. Deshalb sind in diesen Copolymeren die Monomereinheiten statistisch verteilt. Die bei Silikonen üblichen Bezeichnungen M, D, T und Q zur Beschreibung der Struktur finden bei Polysilazanen kaum Verwendung.
Herstellung
Als Ausgangsmaterialien bei der Polysilazanherstellung verwendet man meist die großtechnisch verfügbaren und preiswerten Chemikalien Ammoniak und Chlorsilane. Bei der Ammonolysereaktion entstehen große Mengen Ammoniumchlorid, die vom Produkt abgetrennt werden müssen.
- R2SiCl2 + 3 NH3 → 1/n [R2Si–NH]n + 2 NH4Cl
Im Labormaßstab wird diese Reaktion in einem trockenen organischen Lösungsmittel durchgeführt (die Silazane zersetzen sich in Gegenwart von Wasser), in dem sich Ammoniumchlorid nicht löst, und anschließend wird filtriert. Da der Filtrationsschritt sehr zeit- und kostenintensiv ist, wurden Herstellmethoden entwickelt, bei denen im letzten Syntheseschritt keine Feststoffe entstehen.
Das Flüssig-Ammoniak-Verfahren zur Polysilazan-Synthese wurde von Commodore/KiON entwickelt. Dabei wird das Chlorsilan oder Chlorsilan-Mischungen in einen Überschuss aus flüssigem Ammoniak dosiert. Das entstehende Ammoniumchlorid löst sich im Ammoniak und bildet neben dem Silazan eine zweite flüssige Phase. Die beiden Flüssigkeiten lassen sich dann an der Grenzfläche voneinander trennen. Dieses patentierte Verfahren wird von AZ Electronic Materials (inzwischen Teil der Merck KGaA) zur Herstellung von Polysilazanen genutzt.
Bei den ehemals von der Hoechst AG vertriebenen Produkten VT 50 und ET 70 handelt es sich um Polysilsesquiazan-Lösungen. Die Herstellung erfolgte in zwei Stufen: zunächst wurde ein Trichlorsilan mit Dimethylamin umgesetzt und das entstehende monomere Aminosilan vom Dimethylammoniumchlorid abgetrennt. Bei der anschließenden Umsetzung des Aminosilans mit Ammoniak entsteht salzfrei ein Polymer.
Wird als Quelle für den Stickstoff statt Ammoniak Hexamethyldisilazan (HMDS) verwendet, findet eine Transaminierung statt. Die aus dem Chlorsilan freiwerdenden Chlor-Atome werden an die Trimethylsilylgruppen des HMDS gebunden, so dass kein chlorhaltiger Feststoff entsteht. Dieses Verfahren wurde von Dow Corning zur Herstellung des Hydridopolysilazans HPZ genutzt.
Zahlreiche weitere Verfahren zum Aufbau von polymeren SiN-Gerüsten wurden in der Literatur beschrieben (z. B. dehydrierende Kupplung zwischen Si–H und N–H, Ringöffnungspolymerisationen), wurden aber nicht in großem Maßstab genutzt.
Zur industriellen Herstellung von Perhydropolysilazan [H2Si–NH]n bedient man sich nach wie vor der Ammonolyse in einem Lösungsmittel. Der dadurch höhere Preis wird in der Elektronikindustrie wegen der besonderen Eigenschaften (u. a. isolierende Wirkung bei geringer Schichtdicke) als Beschichtungsmaterial in Kauf genommen. Das Produkt ist als ca. 20%ige Lösung verfügbar.
Nomenklatur
Silicium-Stickstoff-Verbindungen mit alternierend angeordneten Silicium- („sila“) und Stickstoffatomen („aza“) werden als Silazane bezeichnet. Einfache Vertreter der Silazane sind das Disilazan H3Si–NH–SiH3 und das Hexamethyldisilazan (H3C)3Si–NH–Si(CH3)3. Ist nur ein Siliciumatom an das Stickstoffatom gebunden, spricht man von Silylaminen oder Aminosilanen (z. B. Triethylsilylamin (H5C2)3Si–NH2). Sind drei gerüstbildende Stickstoffatome um das Siliciumatom angeordnet, heißen die Verbindungen Silsesquiazane. Kleine ringförmige Moleküle mit einem Grundgerüst aus Si-N bezeichnet man als Cyclosilazane (z. B. Cyclotrisilazan [H2Si–NH]3). Polysilazane hingegen sind polymere Silazane, die aus unterschiedlich großen Ketten und Ringen aufgebaut sind und eine Molmassenverteilung aufweisen. Ein Polymer mit der allgemeinen Formel (CH3)3Si–NH–[(CH3)2Si-NH]n–Si(CH3)3 wird als Poly(dimethylsilazan) bezeichnet. Nach den IUPAC-Regeln zur Benennung linearer organischer Polymere müsste die Verbindung eigentlich Poly[aza(dimethylsilylen)], nach den vorläufigen Regeln für anorganische Makromoleküle catena-Poly[(dimethylsilicium)-m-aza] genannt werden.
Eigenschaften
Polysilazane sind farblose bis gelbe Flüssigkeiten oder Feststoffe. Herstellungsbedingt enthalten die Flüssigkeiten oft gelöstes Ammoniak, das den Geruch dominiert. Die mittlere Molekülmasse kann von wenigen tausend bis ca. 100.000 g/mol betragen, während die Dichte meist um 1 g/cm3 liegt. Der Aggregatzustand und die Viskosität sind sowohl von der Molekülmasse als auch von der molekularen Makrostruktur abhängig. Feste Polysilazane werden durch chemische Umsetzungen aus flüssigen hergestellt (Verknüpfung kleinerer Moleküle zu größeren, Vernetzung). Die Feststoffe können schmelzbar oder unschmelzbar und in organischen Lösungsmitteln löslich oder unlöslich sein. In der Regel handelt es sich um Duromere, in manchen Fällen ist aber eine thermoplastische Verarbeitung möglich.
Nach der Synthese findet häufig ein Alterungsprozess statt, bei dem gelöstes Ammoniak eine wichtige Rolle spielt. Die bei der Ammonolyse entstehenden R3Si–NH2-Gruppen bilden unter Abspaltung von Ammoniak Silazan-Einheiten. Kann das Ammoniak nicht entweichen, werden Silazan-Einheiten auch wieder aufgespalten in R3Si–NH2-Gruppen. Damit kann ein häufiger Gaswechsel über den Flüssigkeiten zur Erhöhung der Molekülmasse führen (Entzug von Ammoniak). Auch funktionelle Gruppen, die nicht direkt in das Grundgerüst eingebunden sind, können unter geeigneten Bedingungen miteinander reagieren (z. B. Si–H- mit N–H-Gruppen), wodurch eine zunehmende Vernetzung der Ringe und Ketten auftritt. Ein Anstieg der Molekülmasse kann auch bei längerer Lagerung bei erhöhter Temperatur oder im Sonnenlicht beobachtet werden.
Bei Kontakt mit Wasser oder (Luft-)Feuchtigkeit zersetzen sich Polysilazane mehr oder weniger schnell. Die Wassermoleküle greifen dabei am Si-Atom an, und die Si–N-Bindung wird aufgebrochen. Aus R3Si–NH–SiR3 entstehen zunächst R3Si–OH und H2N–SiR3, die dann weiterreagieren (Kondensation), wodurch am Ende R3Si–O–SiR3-Einheiten (Siloxane) gebildet werden. Die Geschwindigkeit der Reaktion mit Wasser (oder anderen OH-haltigen Verbindungen wie Alkoholen) hängt von der molekularen Struktur der Polysilazane und den Substituenten ab. So kann sich das Perhydropolysilazan [H2Si–NH]n bei Kontakt mit Wasser in einer sehr schnellen, stark exothermen Reaktion zersetzen, während Polysilazane mit voluminösen Seitengruppen nur langsam reagieren.
Beim Erhitzen von Polysilazanen können hochmolekulare Verbindungen nicht in die Gasphase übergehen, da die zwischenmolekularen Kräfte zu groß sind. Bei Temperaturen von 100 bis 300 °C findet daher eher eine weitere Vernetzung der Moleküle unter Abspaltung von Wasserstoff und Ammoniak statt. Enthält das Polysilazan weitere funktionelle Gruppen wie z. B. Vinyl-Einheiten, treten zusätzliche Reaktionen auf. Flüssige Verbindungen werden daher bei Temperaturerhöhung in der Regel fest. Im Bereich von 400 bis 700 °C zersetzen sich die organischen Gruppen unter Abspaltung von kleinen Kohlenwasserstoffmolekülen, Ammoniak und Wasserstoff. Zwischen 700 und 1200 °C entsteht dann ein dreidimensionales amorphes Netzwerk aus Si, C und N („SiCN-Keramik“) mit einer Dichte von ca. 2 g/cm3. Bei weiterer Temperaturerhöhung kann das amorphe Material kristallisieren, wobei sich Siliciumnitrid, Siliciumcarbid und Kohlenstoff bilden. Diese so genannte Pyrolyse der Polysilazane erzeugt aus niedrigviskosen Flüssigkeiten keramische Materialien in hoher Ausbeute, die bei über 90 Masse-% liegen kann. In der Regel ist sie jedoch deutlich geringer (60–80 %), da die organischen Gruppen, die die keramische Ausbeute reduzieren, für eine gute Verarbeitbarkeit im Polymerzustand nötig sind.
Anwendungsbeispiele
Obwohl die Polysilazane seit langem bekannt sind und ihnen frühzeitig ein großes Anwendungspotential bescheinigt wurde, haben bislang nur wenige Produkte Marktreife erreicht. Das liegt sicherlich auch im hohen Entwicklungsaufwand beim Einsatz dieser vergleichsweise „teuren“ Chemikalien begründet. Die in der Vergangenheit mangelhafte Verfügbarkeit von Polysilazanen ist sowohl Ursache als auch Folge davon. Für einige Anwendungen hat sich das Eigenschaftsprofil der Verbindungen jedoch als so vorteilhaft erwiesen, dass heute konkurrenzfähige Polysilazan-Produkte kommerziell verfügbar sind.

Die Reaktivität von Polysilazanen gegenüber Feuchtigkeit und polaren Oberflächen wird bei ihrer Verwendung als Beschichtungsmaterial ausgenutzt. Wird ein dünner Film auf ein Substrat aufgebracht, das an der Oberfläche OH-Gruppen enthält (z. B. viele Metalle, Glas, Keramik, aber auch Kunststoffe), können sich an der Grenzschicht Si–O-Bindungen ausbilden, die für eine chemische Verankerung des Polysilazans auf dem Substrat sorgen. Das erzeugt eine sehr gute Substrathaftung. Die freie Oberfläche der Beschichtung kann mit Luftfeuchtigkeit reagieren, wobei sich im Falle der Organopolysilazane Siloxan-ähnliche Strukturen bilden, die hervorragende Easy-to-clean-Eigenschaften aufweisen können. So benutzt beispielsweise die Deutsche Bahn ein Organopolysilazan-basiertes Produkt mit dem Handelsnamen tutoProm® zum Schutz vor Graffiti und zur Lackauffrischung auf Bahnwaggons. Darüber hinaus finden Organopolysilazane in Hochtemperaturlacken sowie Korrosionsschutzsystemen Anwendung.

Das anorganische Perhydropolysilazan kann in gleicher Weise verwendet werden. Es bietet jedoch zusätzlich den Vorteil, dass nach der vollständigen Aushärtung an Luft ein Kohlenstoff-freies SiOx-Netzwerk entsteht. Die Schichten sind dadurch zwar weniger flexibel, dafür aber sehr glatt und sehr dicht, weshalb sie eine ausgezeichnete Barrierewirkung (beispielsweise für Sauerstoff oder Wasserdampf) zeigen. Da solche glasartigen Schichten naturgemäß auch gute Isolatoren sind, findet das Perhydropolysilazan sowohl in der Elektronik- als auch in der Solarindustrie Anwendung.
Aufgrund der chemischen Reaktivität der Polysilazane wird auch die Verwendung als Kunstharz oder als Kunstharz-Härter untersucht. Die Anwendung ist noch nicht voll entwickelt, zielt aber auf die Herstellung nicht brennbarer Verbundwerkstoffe ab. Entsprechend vorbehandelte Formteile haben sich im Experimentierstadium für den Einsatz im kritischen Temperaturbereich zwischen 400 und 600 °C bewährt, in dem andere Kunststoffe in der Regel versagen.
Die Polysilazane besitzen als präkeramische Polymere auch Anwendungspotential in der Keramikindustrie. In der Keramik ist die Herstellung komplexer Formen sehr schwierig bzw. sehr teuer. Mit geeigneten organischen Bindemitteln lassen sich zwar spritzgussfähige Massen herstellen; es folgt aber ein zeitintensiver Entbinderungsvorgang, der fragile „Weißlinge“ erzeugt, und das Schrumpfen beim Sintern muss untersucht und erfasst werden. Präkeramische Polymere könnten die organischen Bindemittel ersetzen. Statt des Entbinderns würde der Grünling pyrolysiert, wodurch sich ein vergleichsweise dichtes Formteil (hohe keramische Ausbeute der Polymere) endkonturnäher fertigen ließe. Zumindest im zivilen Bereich steckt diese Anwendung aber noch in den Kinderschuhen.
Aufgrund ihrer chemischen Variabilität lassen sich physikalisch-chemische Eigenschaften der präkeramischen Polymere gezielt einstellen. Davon zeugen viele an Forschungseinrichtungen und in der Industrie durchgeführte Versuche zur Herstellung von keramischen Fasern für Verbundwerkstoffe. Die aus Polycarbosilanen hergestellte SiC-Faser spielt dabei eine Vorreiterrolle. Die Herstellung von Si3N4-Fasern aus Perhydropolysilazan wurde Ende der 1980er Jahre von Tonen Corp. beschrieben, Dow Corning nutze das modifizierte HPZ-Polymer zur Erzeugung von SiCN-Fasern, während die Hoechst AG erfolgreiche Versuche mit VT50 durchführte.
Literatur
- C.R. Krüger, E.G. Rochow, J. Polym. Sci. Vol. A2, 1964, S. 3179–3189
- Polymer Derived Ceramics, Hrsg. G. Soraru, R. Riedel, A. Kleebe, P. Colombo, DEStech publications, Inc. 2010
- R. Riedel, A. Gurlo, E. Ionescu: Synthesemethoden für keramische Materialien, Hochtechnologiewerkstoffe. In: Chemie in unserer Zeit 44, Nr. 3, 2010, 208–227
- M. Mahn, F. Osterod, S. Brand, Farbe und Lack 114, 2008, 22–24
- S. Brand, M. Mahn, F. Osterod, Farbe und Lack 116, 2010, 25–29