Pimelinsäure
Pimelinsäure (auch Heptandisäure oder 1,5-Pentandicarbonsäure) gehört zur homologen Reihe der Dicarbonsäuren. Der Name leitet sich auch dem Griechischen pimele (=Fett) ab.[4] Sie liegt in dieser zwischen der Adipinsäure und der Suberinsäure (Korksäure). Ihre Salze heißen Pimelate.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
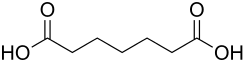 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Pimelinsäure | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C7H12O4 | |||||||||||||||||||||
| Kurzbeschreibung |
weiße Kristalle[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 160,17 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,33 g·cm−3[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
223 °C[1] | |||||||||||||||||||||
| pKS-Wert | ||||||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (50 g·l−1 bei 20 °C)[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Im Gegensatz zur Adipinsäure findet die Pimelinsäure ein nur sehr begrenztes Anwendungsgebiet in der chemischen Industrie.
Eigenschaften
Als zweiwertige Säure dissoziiert Pimelinsäure in Wasser in zwei Protolysestufen. Ihr Octanol-Wasser-Verteilungskoeffizient beträgt log (KOW) = 0,61.[1]
Biologische Bedeutung
Pimeloyl-CoA ist eine Komponente der Biosynthese von Biotin.[5]
Einzelnachweise
- Datenblatt Pimelinsäure (PDF) bei Merck, abgerufen am 13. Februar 2010.
- Fieser und Fieser, Organische Chemie, 2. Auflage, Verlag Chemie 1982 ISBN 3-527-25075-1.
- Datenblatt Pimelic acid bei Sigma-Aldrich, abgerufen am 20. April 2011 (PDF).
- Roempp Chemie Lexikon 9. Auflage 1991 Stichwort Pimelinsäure
- Paola Estrada, Miglena Manandhar, Shi-Hui Dong, Jaigeeth Deveryshetty, Vinayak Agarwal, John E. Cronan, Satish K. Nair: The pimeloyl-CoA synthetase BioW defines a new fold for adenylate-forming enzymes. In: Nature Chemical Biology. 13, 2017, S. 668–674, doi:10.1038/nchembio.2359.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. The authors of the article are listed here. Additional terms may apply for the media files, click on images to show image meta data.
