Baldwin-Regeln
Als Baldwin-Regeln bezeichnet man die Sammlung von Regeln, die Voraussagen über die kinetische Bevorzugung chemischer Reaktionen mit cyclischen Übergangszuständen, meist Ringschlussreaktionen, erlauben. Benannt wurden sie nach ihrem Entdecker Jack Baldwin.
Nomenklatur
Die Baldwin-Regeln bedienen sich einer speziellen Terminologie, bei welcher ein Ringschluss durch drei Parameter charakterisiert wird:
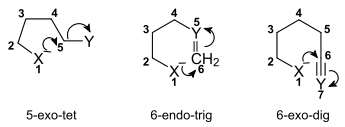
- Die Größe des kleinsten neu gebildeten Rings wird in arabischen Ziffern angegeben.
- Die Stellung der gespaltenen Bindung relativ zum neu gebildeten Ring wird mit den Bezeichnungen exo bzw. endo angegeben. Hierbei bedeutet exo, dass die gebrochene Bindung weg vom kleinsten gebildeten Ring zeigt, und endo, dass diese im Ring liegt.
- Die Geometrie des Atoms, welches den Ringschluss eingeht, wird durch die Abkürzungen dig, trig bzw. tet angegeben. Diese richtet sich nach der Hybridisierung des Atoms: Wird ein sp-hybridisiertes Zentrum angegriffen, so sind dessen Bindungspartner digonal (also linear) angeordnet. Bei einem sp2-hybridisierten Zentrum stehen dessen Bindungspartner trigonal-planar zueinander, während sie bei einem sp3-hybridisierten Zentrum tetraedrisch angeordnet sind.
Für die Nomenklatur des Ringschlussmechanismus werden oben genannte Merkmale – jeweils durch Bindestriche voneinander getrennt – in der angegebenen Reihenfolge genannt.
Bevorzugte und benachteiligte Mechanismen
| exo | endo | |||||
| dig | trig | tet | dig | trig | tet | |
| 3 | X | ✓ | ✓ | ✓ | X | X |
| 4 | X | ✓ | ✓ | ✓ | X | X |
| 5 | ✓ | ✓ | ✓ | ✓ | X | X |
| 6 | ✓ | ✓ | ✓ | ✓ | ✓ | X |
| 7 | ✓ | ✓ | ✓ | ✓ | ✓ | X |
Mit Hilfe der Baldwin-Regeln kann bewertet werden, ob es wahrscheinlich ist, dass ein bestimmter Mechanismus zu einem Ringschluss führt. Es handelt sich wohlgemerkt nicht um absolute Aussagen, daher unterteilt man nicht in „erlaubte“ und „verbotene“, sondern in „bevorzugte“ und „benachteiligte“ Reaktionen. Die Regeln sind allerdings nur anwendbar, wenn das nukleophile Reaktionszentrum auch im jeweils bevorzugten Angriffswinkel angreifen kann: Für tet-Zentren beträgt der optimale Winkel 180° (analog zur Walden-Umkehr), für trig-Zentren etwa 107° (siehe auch Bürgi-Dunitz-Trajektorie) und für dig-Zentren 120°. Ist aufgrund der vorliegenden Molekülgeometrie dieser Angriffswinkel nicht zugänglich, wird kein Ringschluss erfolgen, selbst wenn die Reaktion nach Baldwin eigentlich bevorzugt ablaufen sollte.
Die Baldwin-Regeln beruhen auf dem Prinzip, dass all diejenigen Ringschlussmechanismen benachteiligt erfolgen, für deren Ablauf eine starke Verzerrung der Bindungswinkel und -längen im Molekül nötig wäre. Im Speziellen sind dies:
- 3-exo-dig und 4-exo-dig
- 3-endo-trig, 4-endo-trig und 5-endo-trig
5-endo-trig-Reaktionen mögen gezeichnet schlüssig erscheinen, sind aber nicht plausibel und finden daher nicht statt.
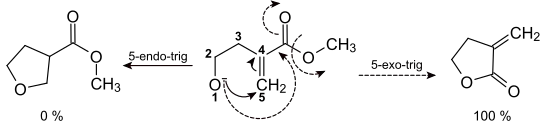
Endo-tet-Reaktionen führen nicht zu Ringschlüssen. Trotzdem können sie durch die Baldwin-Regeln vorhergesagt werden. Benachteiligt sind:
- 5-endo-tet und 6-endo-tet
In der Tabelle rechts sind die Baldwin-Regeln für Drei- bis Siebenringe zusammengestellt; dabei laufen grün markierte Reaktionsmechanismen bevorzugt ab, während die rot gekennzeichneten benachteiligt sind. Mit ihrer Hilfe ist es möglich, das favorisierte Produkt vorherzusagen, wenn wie im nebenstehenden Beispiel mehrere Reaktionswege denkbar sind.
Folgende Punkte sollte man zusätzlich beachten:
- Die Baldwin-Regeln treffen eine Vorhersage über kinetische Wahrscheinlichkeiten, nicht über Thermodynamik (z. B. Gleichgewichte). Bei bevorzugten Reaktionen ist also die Rückreaktion ebenfalls kinetisch bevorzugt. Genauso können thermodynamisch begünstigte Reaktionen im Anschluss oder stattdessen erfolgen.
- Kationen und Moleküle mit Elementen der 3. Periode gehorchen den Baldwin-Regeln oft nicht.
- Reaktionen, die den Baldwin-Regeln zu widersprechen scheinen, können durch intermolekulare Mechanismen zustande gekommen sein.
- Nukleophile sp2-Zentren, z. B. Enolate, müssen gesondert betrachtet werden, da die Orbitalsymmetrie von π-Orbitalen anders ist.
Literatur
- J. E. Baldwin: Rules for Ring Closure. In: J. Chem. Soc., Chem. Commun. Nr. 18, 1976, S. 734–736. doi:10.1039/C39760000734; PDF (280 kB).
- J. E. Baldwin, J. Cutting u. a.: 5-Endo-Trigonal Reactions: a Disfavoured Ring Closure. In: J. Chem. Soc., Chem. Commun. Nr. 18, 1976, S. 736–738. doi:10.1039/C39760000736; PDF (220 kB).
- J. E. Baldwin, R. C. Thomas u. a.: Rules for ring closure: ring formation by conjugate addition of oxygen nucleophiles. In: J. Org. Chem. Bd. 42, Nr. 24, 1977, S. 3846–3852. doi:10.1021/jo00444a011.
- J. E. Baldwin, L. I. Kruse: Rules for ring closure. Stereoelectronic control in the endocyclic alkylation of ketone enolates. In: J. Chem. Soc., Chem. Commun. Nr. 7, 1977, S. 233–235. doi:10.1039/C39770000233.
- J. E. Baldwin, M. J. Lusch u. a.: Rules for ring closure: application to intramolecular aldol condensations in polyketonic substrates. In: Tetrahedron. Bd. 38, Nr. 19, 1982, S. 2939–2947. doi:10.1016/0040-4020(82)85023-0.
- C. D. Johnson: Stereoelectronic effects in the formation of 5- and 6-membered rings: the role of Baldwin's rules. In: Acc. Chem. Res. Bd. 26, Nr. 9, 1993, S. 476–482. doi:10.1021/ar00033a004.
- J. Clayden, N. Greeves u. a.: Organic Chemistry. In: Chapter 42, S. 1140ff.; Oxford University Press, USA, 2001, ISBN 0-19-850346-6.
- F. A. Carey, R. J. Sundberg: Organische Chemie. Ein weiterführendes Lehrbuch. S. 157ff.; Verlag Chemie, Weinheim, 1995, ISBN 3-527-29217-9.