Phencyclidin
Phencyclidin (Abkürzung von Phenylcyclohexylpiperidin, kurz PCP), in der Drogenszene auch als Angel Dust (Engelsstaub) oder Peace Pill bezeichnet, ist ein als Droge genutztes Dissoziativum aus der Gruppe der Arylcyclohexylamine. Das Unternehmen Parke-Davis entwickelte es 1956 ursprünglich als Arzneistoff der Klasse der Anästhetika, seine Vermarktung wurde jedoch bald darauf auf Grund eines ungünstigen Nutzen-Risiko-Verhältnisses eingestellt. Insbesondere nach Langzeitgebrauch besteht die Gefahr einer psychischen Abhängigkeit. Im Tierversuch schädigt es das Hirngewebe. In Deutschland unterliegt Phencyclidin dem Betäubungsmittelgesetz und ist nicht verkehrsfähig.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
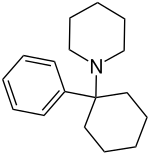 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Phencyclidin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel |
| |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
135–137 °C (133,3 Pa)(Phencyclidin) [1] | |||||||||||||||||||||
| pKS-Wert |
8,29[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Pharmakologie
Wirkprofil
Der genaue Wirkungsmechanismus von Phencyclidin ist unbekannt. Seine Wirkung wird auf Interaktionen mit NMDA-Rezeptoren zurückgeführt, in dem es den offenen Kanal blockiert und inaktiviert (open channel blocker). Dies ist ein Merkmal, das es mit anderen Dissoziativa teilt. Hinsichtlich dieser Wirkungsweise ähnelt Phencyclidin am ehesten Ketamin, seine Wirkung ist jedoch stärker psychotisch und weniger analgetisch (schmerzdämpfend).
Nebenwirkungen
Die halluzinogene Wirkung des PCP ähnelt der Wirkung von LSD,[5] daneben kommen dissoziative Zustände wie bei Distickstoffmonoxid[6] und Ketamin vor.[7]
In Verbindung mit der Anwendung von Phencyclidin konnten insbesondere Benommenheit, Schläfrigkeit, Amnesie, Wahrnehmungsstörungen, Sprach- und Koordinationsstörungen, Störungen der Motorik (insbesondere Augenrollen, Gangstörungen), Speichelfluss, Halluzinationen und Aggressivität bis hin zu Tobsuchtsanfällen mit Eigen- und Fremdgefährdung bei gleichzeitiger Schmerzunempfindlichkeit beobachtet werden.[5] PCP ruft einen Rauschzustand hervor, welcher dem des akuten schizophrenen Schubs ähnlich sein soll. PCP löst dabei nicht nur die typische schizophrene Positiv-Symptomatik (z. B. Wahn, Halluzinationen, Ich-Störungen) aus, sondern auch die Negativ-Symptomatik (z. B. Apathie, Alogie, Affektverarmung, Anhedonie). Ebenso treten Angstzustände in Form albtraumartiger psychotischer Episoden auf (Horrortrip). Bei hoher Dosierung von PCP können Krampfanfälle und schließlich der Tod durch Atemdepression eintreten.[5]
Neurotoxizität
Eine Schädigung des Nervensystems kann insbesondere bei längerer Anwendung eintreten. Phencyclidin kann, wie andere NMDA-Blocker auch, Hirnschädigungen verursachen. Phencyclidin ist toxischer und in seiner Toxizität komplexer als andere Dissoziativa. Die Schädigungen betreffen mehrere Hirnregionen und werden wahrscheinlich über verschiedene Rezeptorsysteme vermittelt.[8][9]
Langzeitkonsum
Nach häufigem Gebrauch von Phencyclidin wurden oft tagelang anhaltende schizophrenieartige Zustände mit Gedächtnisverlust,[5] burn-out-Gefühl,[5] Paranoia, Verwirrung, Aggressivität und unkontrollierte Halluzinationen – auch ohne Einnahme der Droge – beobachtet. Ob die Phencyclidinablagerung in Fettgewebe und Hirn (Depot-Wirkung) oder die Neurotoxizität dieser Substanz dies bedingt, ist nicht geklärt.
Wechselwirkungen
Der Mischkonsum von Phencyclidin und Alkohol kann Effekte verstärken und Halluzinationen, Ohnmacht, Atemdepression und Atemstillstand mit Juckreiz bewirken.
Metabolismus
Etwa 80 % des Phencyclidins werden im menschlichen Organismus in der 4-Stellung der Ringe hydroxyliert und als Glucuronid im Harn ausgeschieden. Bei der Hydroxylierung entsteht auch N-Cyclohexyl-N-phenyl-5-aminopentansäure. Der hydroxylierte Metabolit hat keine psychoaktive Wirkung. Von den verbleibenden 20 % des Phencyclidin wird ein kleiner Teil oxidativ zu Phenylcyclohexamin gespalten.
Gegenmaßnahmen bei einer akuten Überdosis/bei Ausbruch einer (temporären) Drogenpsychose
Es gibt kein bekanntes Antidot, das Phencyclidin aus seinen Rezeptorbindungen löst, somit erfolgen die Gegenmaßnahmen rein symptomatisch. Meist wird der Patient fixiert, um aggressive und eventuell gefährdende Handlungen gegenüber sich selbst und anderen auszuschließen. Danach wird in der Regel intravenös ein schnell wirksames und hochpotentes Neuroleptikum verabreicht (häufig Haloperidol), um die Wahnvorstellungen und die Aggressionen zu mindern. Der Patient wird dann sediert, in der Regel mit mittellang wirksamen Benzodiazepinen. Meist muss der Konsument noch mehrere Tage in stationärer Überwachung bleiben, da „Flashbacks“ auftreten können, die eine erneute Gefahr für ihn und seine Umwelt darstellen.
Chemie
Phencyclidinhydrochlorid in reiner Form ist ein weißes kristallines Pulver („Engelsstaub“). PCP ist chemisch verwandt mit dem Anästhetikum Ketamin. Derivate: Tenocyclidin, Eticyclidin, Rolicyclidin.
Nachweis
Der Nachweis erfolgt durch eine modifizierte Fassung des Scott-Tests. Mit Marquis-Reagenz reagiert PCP wie alle anderen tertiären Phencyclidine zu einem roten Farbkomplex. Anschließend erfolgt eine Dünnschichtchromatografie zur Zerlegung in die Reinstoffe mit gekoppelter Spektralanalyse, die unter UV-Licht zwei Spitzen bei λ=257 nm und λ=261 nm und zwei Teilschultern bei λ=252 nm und λ=266 nm sichtbar macht.
Synthese
Die Synthese erfolgt in zwei Schritten. Zunächst reagieren Cyclohexanon 1 und Piperidin 2 zu einem Enamin 3. Durch eine Grignard-Reaktion mit Phenylmagnesiumbromid entsteht dann Phencyclidin 4. Die erste Synthese erfolgte 1926 durch Kötz und Merkel.[10]

Eine Alternative stellt die Strecker-Synthese mit Kaliumcyanid zum α-Aminonitril und anschließender Grignard-Reaktion dar. Mechanistisch gesehen entsteht durch Verlust des Cyanidions ein Iminiumion, das dann vom Grignard-Reagenz angegriffen wird. Die Reaktion ist unter dem Namen Bruylants-Reaktion bekannt.
Anwendung als Rauschmittel
.jpg.webp)
Phencyclidin wird hauptsächlich in den USA als Freizeitdroge konsumiert.[11] Die örtlich begrenzte Nachfrage wird dort durch illegale Produktion gedeckt, die vergleichsweise günstig ist. Phencyclidin wird als Pulver oder in gelöster Form insbesondere nasal („schniefen/ziehen“), peroral (Schlucken) oder inhalativ (Rauchen) angewendet.[5] Ebenso wird mit Phencyclidin imprägniertes Pflanzenmaterial (unter anderem Cannabis, Minze etc.) zum Rauchen verwendet.
Geschichte
Die Grundlage zur Herstellung von Phencyclidin wurde 1926 durch eine Studie von Arthur Kötz und Paul Merkel gelegt, die über die Reaktion von der verwandten Verbindung 1-Piperidinocyclohexancarbonitril (PCC) mit Grignard-Verbindungen berichteten.[12] Nachdem die ruhigstellende Wirkung von Phencyclidin an Affen erfolgreich erprobt war, wurde Phencyclidin 1956 in Deutschland unter dem Handelsnamen Sernylan (CI-395) von der Firma Parke Davis and Co. als Tieranästhetikum auf den Markt gebracht.[13][14] 1963 erfolgte die Zulassung als dissoziatives Anästhetikum unter dem Markennamen Sernyl zur Anwendung am Menschen, wurde jedoch wegen seiner starken psychischen Nebenwirkungen bereits vier Jahre später wieder vom Markt genommen.[5] Bis heute ist es in den USA für veterinärmedizinische Zwecke zugelassen.[5]
1967 tauchte es erstmals bei einem Rock-Festival in San Francisco in der Drogenszene auf und geriet wegen seiner falsch deklarierten Wirkung zunächst wieder in Vergessenheit. Aufgrund der Wirksamkeit als Rauschmittel wurde der Einsatz als Tieranästhetikum gleichzeitig verboten. 1977 tauchte die Substanz bei in Deutschland stationierten US-Streitkräften wieder auf und erfuhr von dort eine Verbreitung in Untergrundlaboratorien, die Abwandlungen am Molekülgerüst vornahmen, um die halluzinogene Wirkung zu verstärken. Derzeit sind mehr als 125 Phencyclidin-Derivate bekannt (siehe dazu: Liste der Arylcyclohexylamine).
Vermutlich spielte Phencyclidin auch bei dem Massaker an der Grover Cleveland Elementary School in San Diego (1979, bekannt durch den sich darauf beziehenden Bob-Geldof-Song I don't like Mondays) eine Rolle: Die Täterin Brenda Ann Spencer soll nach eigenen Angaben während ihrer Amok-Tat unter dem Einfluss von Phencyclidin gestanden haben. Laut Anklage war sie während der Tat nüchtern.[15][16]
In den Vereinigten Staaten[17] und Südafrika[18] wurde Phencyclidin als chemische Waffe (Psychokampfstoff) unter den Bezeichnungen Agent SN und EA 2148 hergestellt.[17][18]
Literatur
- Karl-Artur Kovar: Designer-Drogen der Phencyclidin-Reihe. Pharmazie in unserer Zeit. 23. Jahrg. 1994
- Richard Seymour: The New Drugs. Look-Alikes, Drugs of Deception and Designer Drugs. San Francisco 1989.
Weblinks
- PCP. In: Erowid. (englisch)
- Drugscouts über PCP
- ChemSub Online: Phencyclidin
Einzelnachweise
- The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals, 14. Auflage (Merck & Co., Inc.), Whitehouse Station, NJ, USA, 2006; S. 1246, ISBN 978-0-911910-00-1.
- Eintrag zu Phencyclidine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Datenblatt Phencyclidine hydrochloride bei Sigma-Aldrich, abgerufen am 18. April 2011 (PDF).
- Eintrag zu Phencyclidine hydrochloride in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- T. Geschwinde: Rauschdrogen: Marktformen und Wirkungsweisen. Springer-Verlag, 2013. ISBN 9783662096819. S. 68.
- F.H. Meyers, E. Jawetz, A. Goldfien: Lehrbuch der Pharmakologie: Für Studenten der Medizin aller Studienabschnitte und für Ärzte. Springer-Verlag, 2013. ISBN 9783642661839. S. 59.
- Heinz Lüllmann, Klaus Mohr: Pharmakologie und Toxikologie. Georg Thieme Verlag, 2006. ISBN 9783133685160. S. 356.
- R. Nakki et al. (1995): Cerebellar toxicity of phencyclidine. In: J. Neurosci. Bd. 3, S. 2097–2108. PMID 7891155.
- F.R. Sharp et al. (1994): Neuronal injury produced by NMDA antagonists can be detected using heat shock proteins and can be blocked with antipsychotics. In: Psychopharmacol Bull, Bd. 30, S. 555–560. PMID 7770620.
- Daniel Trachsel, Nicolas Richard: Psychedelische Chemie: Aspekte psychoaktiver Moleküle. Schwabe AG, 2015. ISBN 9783037882368.
- Felix Tretter: Suchtmedizin kompakt: Suchtkrankheiten in Klinik und Praxis. Schattauer Verlag, 2012. ISBN 9783794528660. S. 250.
- A. Kötz, Paul Merkel: Zur Kenntnis hydroaromatischer Alkamine. In: Journal für Praktische Chemie. 113, 1926, S. 49, doi:10.1002/prac.19261130107.
- A. T. Shulgin, D. E. MacLean: Illicit Synthesis of Phencyclidine (PCP) and Several of its Analogs. In: Clinical Toxicology. 9, 2008, S. 553, doi:10.3109/15563657608988157.
- Wolfram Keup: Biologie der Sucht. Springer-Verlag, 2013, ISBN 978-3-642-82542-2, S. 313 (eingeschränkte Vorschau in der Google-Buchsuche).
- 'I Don't Like Mondays'. In: Boomtown Rats.co.uk. 2003. Archiviert vom Original am 14. Februar 2012. Abgerufen am 29. Februar 2012., with details about the case.
- Background: I Don't Like Mondays (Bob Geldof). In: The Mudcat Cafe (forum). Abgerufen am 29. Februar 2012.
- Reid Kirby: Paradise Lost: The Psycho Agents. (PDF; 379 kB) The CBW Conventions Bulletin, Issue 71, S. 2, Mai 2006.
- Chandré Gould, Peter I. Folb, Robert Berold(Hrsg.): Project Coast: Apartheid's Chemical and Biological Warfare Programme. United Nations Publications UNIDIR, 2002, S. 92, ISBN 978-9290451440.
