Osimertinib
Osimertinib ist ein oraler irreversibler Epidermis-Wachstumsfaktor-Rezeptor–Tyrosinkinase-Inhibitor der dritten Generation (englisch Epidermal Growth Factor Receptor–Tyrosine-kinase inhibitor, EGFR-TKI), der selektiv sowohl EGFR-TKI-sensibilisierende, als auch EGFR-T790M-Resistenzmutationen hemmt. Es ist für die Erstlinientherapie von erwachsenen Patienten mit lokal fortgeschrittenem oder metastasiertem nichtkleinzelligen Lungenkarzinom (englisch non small cell lung cancer, NSCLC) mit aktivierenden Mutationen des epidermalen Wachstumsfaktor-Rezeptors (englisch Epidermal Growth Factor Receptor, EGFR) vorgesehen.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
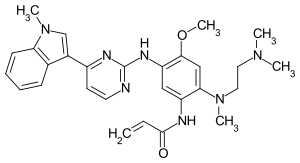 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Osimertinib | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel |
| |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code |
L01XE35 | |||||||||||||||
| Wirkstoffklasse | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 499,62 g·mol−1 (Osimertinib) | |||||||||||||||
| Schmelzpunkt |
>188 °C (Zersetzung)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
EGFR-Mutation T790M
Die T790M-Mutation im Exon 20 des EGFR-Gens ist die häufigste (primäre oder erworbene) Resistenzmutation beim NSCLC. Irreversible EGFR‐Inhibitoren zeichnen sich durch zusätzliche starke nichtkovalente Bindungsmotive aus und weisen dadurch eine hohe Potenz gegenüber dem Cystein‐mutierten L858R/T790M/C797S‐EGFR‐Enzym auf.[4] Die Am häufigsten mutiert gefundene Aminosäureposition ist Threonin an Position 790 (T790). Meist wird Threonin durch Methionin (M) ersetzt.[5] Threonin ist eine kleine polare Aminosäure. Methionin ist eine größere unpolare Aminosäure.
Klinischer Einsatz
Patienten mit EGFR-sensibilisierenden Mutationen, die mit TKIs der 1. oder 2. Generation behandelt wurden, sollten zum Zeitpunkt der klinischen oder radiologischen Progression auf eine T790M-Mutation getestet werden. Die Ergebnisse sollten die Behandlungsentscheidungen bestimmen. Tests auf das Vorhandensein von EGFR-T790M als Resistenzmechanismus können entweder bevorzugt aus zirkulierender Tumor-DNA (englisch Circulating free DNA, cfDNA) aus Plasma mittels der Liquid Biopsy oder aus der DNA aus dem Gewebe mittels konventioneller Biopsie durchgeführt werden.
Ein positives Ergebnis von T790M aus einem cfDNA-Test kann eine Indikation für eine auf die T790M-Mutation gerichtete Therapie mittels Osimertinib sein. Eine Gewebebiopsie kann folgen, wenn die Liquid Biopsy für T790M negativ ausfällt.[6]
Die Dosierung besteht aus einer Tablette von 80 mg täglich. Für Sonderfälle (beispielsweise Leber- oder Nierenfunktionsstörung) stehen Tabletten mit 40 mg zur Verfügung.
Unerwünschte Nebenwirkungen
Sehr häufige Nebenwirkungen von Osimertinib (die mehr als 1 von 10 Personen betreffen können) sind Durchfall, Ausschlag, trockene Haut, Paronychie (Nagelbettinfektion), Juckreiz, Stomatitis (Entzündung der Mundschleimhaut) und Abnahme der Anzahl von weißen Blutkörperchen und Blutplättchen. Osimertinib darf nicht zusammen mit Johanniskraut (ein pflanzliches Arzneimittel zur Behandlung von Depressionen) angewendet werden.[7] Osimertinib ist ein Substrat von Cytochrom P450 3A4 (CYP3A4), P-Glykoprotein und Breast Cancer Resistance Protein (BCRP, ABCG2).
Metabolismus
In-vitro-Studien lassen darauf schließen, dass Osimertinib vorwiegend durch CYP3A4 und Cytochrom P450 3A5 (CYP3A5) metabolisiert wird. Anhand von in-vitro-Studien wurden zwei pharmakologisch aktive Metaboliten (AZ 7550[8] und AZ 5104[9]) identifiziert. Der Abbau von Osimertinib erfolgt hauptsächlich über Oxidation und Dealkylierung.[10]
Zulassung
Die Therapie mit dem EGFR-Tyrosinkinasehemmer Osimertinib führte gegenüber der Behandlung mit Erlotinib oder Gefitinib zu einem medianen progressionsfreien Überleben von 18,9 Monaten im Vergleich zu 10,2 Monaten. Im November 2015 erteilte darauf hin die US-amerikanische Zulassungsbehörde Food and Drug Administration (FDA) eine beschleunigte Zulassung von Osimertinib für die Behandlung von Patienten bei fortgeschrittenem Lungenkrebs mit aktivierenden EGFR-Mutationen. Die Europäische Kommission folgte mit ihrer Zulassung. In Deutschland ist das Arzneimittel seit Februar 2016 zugelassen, seit 7. Juni 2018[11] als Erstlinientherapeutikum. Die Zulassung basiert auf Ergebnissen der Studie FLAURA.[12][13] Osimertinib ist neben der EU in den USA, Japan, Kanada, Schweiz, Israel, Mexiko, Australien, Südkorea und weiteren Ländern als Erstlinientherapeutikum zugelassen.[14]
Im Mai 2021 wurde die EU-Zulassung erweitert um die adjuvante Behandlung bei EGFR-mutierten NSCLC im Stadium IB-IIIA nach vollständiger Resektion.[15]
Handelsname
Tagrisso®, (AstraZeneca). Osimertinib liegt im Arzneimittel als Osimertinibmesilat vor.
Weiterführende Literatur
- Merkmale des Arzneimittels Tagrisso
- Osimertinib (Tagrisso) bei fortgeschrittenem Lungenkrebs mit aktivierenden EGFR-Mutationen, Gesundheitsinformationsdienst, Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) 15. Oktober 2018
- Nutzenbewertungsverfahren zum Wirkstoff Osimertinib (neues Anwendungsgebiet: nicht-kleinzelliges Lungenkarzinom, Erstlinientherapie), Gemeinsamer Bundesausschuss G-BA
Einzelnachweise
- Eintrag zu AZD 9291 (Osimertinib) bei Toronto Research Chemicals, abgerufen am 4. September 2019 (PDF).
- Gefahrstoffrechtliche Kennzeichnung Arzneistoffe Tumortherapie, BGW
- J-690167 – Osimertinib, Biosynth. Abgerufen am 28. Februar 2019.
- Marcel Günther, Michael Juchum, Gerhard Kelter, Heiner Fiebig, Stefan Laufer: Lungenkrebs: EGFR-Inhibitoren mit hoher Wirksamkeit gegen die therapieresistente L858R/T790M/C797S-Mutante.. In: Angewandte Chemie. 128, 2016, S. 11050, doi:10.1002/ange.201603736.
- D. Ayeni, K. Politi, S. B. Goldberg: Emerging Agents and New Mutations in EGFR-Mutant Lung Cancer. In: Clinical Cancer Research. Band 21, Nummer 17, September 2015, S. 3818–3820, doi:10.1158/1078-0432.CCR-15-1211, PMID 26169963, PMC 4720502 (freier Volltext).
- T. Stockley, C.A. Souza, et. al.: Evidence-based best practices for EGFR T790M testing in lung cancer in Canada. In: Current Oncology. 25, 2018, S. 163, doi:10.3747/co.25.4044.
- Tagrisso (Osimertinib), Europäische Arzneimittel-Agentur, Juni 2018. Abgerufen am 27. Februar 2019.
- Eintrag zu AZ 7550 bei ChemicalBook, abgerufen am 28. Februar 2019.
- Eintrag zu AZ 5104 bei ChemicalBook, abgerufen am 28. Februar 2019.
- Pharmakokinetik Osimertinib, Open Drug Database (ODDB). Abgerufen am 28. Februar 2019.
- Tagrisso: Procedural steps taken and scientific information after the authorisation, Europäische Arzneimittelagentur, abgerufen am 28. Februar 2019.
- AZD9291 Versus Gefitinib or Erlotinib in Patients With Locally Advanced or Metastatic Non-small Cell Lung Cancer (FLAURA), ClinicalTrials.gov, U.S. National Library of Medicine, Letztes Update am 24. Januar 2019. Abgerufen am 27. Februar 2019.
- Jean-Charles Soria, Yuichiro Ohe u. a.: Osimertinib in Untreated-Mutated Advanced Non–Small-Cell Lung Cancer. In: The New England Journal of Medicine. 378, 2018, S. 113 ff, doi:10.1056/NEJMoa1713137.
- TAGRISSO® (Osimertinib) zeigt signifikante Überlegenheit gegenüber Standardchemotherapie bei nicht-kleinzelligem Lungenkarzinom mit EGFR T790M-Mutation, oncotrends. Abgerufen am 1. März 2019.
- https://www.ema.europa.eu/documents/procedural-steps-after/tagrisso-epar-procedural-steps-taken-scientific-information-after-authorisation_en.pdf