Nirmatrelvir
Nirmatrelvir (Entwicklungsname: PF-07321332) ist eine niedermolekulare chemische Verbindung mit antiviraler Wirkung zur Behandlung von COVID-19. Die Substanz wirkt als Proteaseinhibitor und hemmt in vitro das Enzym 3-Chymotrypsin-like Protease (3CLpro), das zu den wichtigsten in Coronaviren vorkommenden Endopeptidasen zählt.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
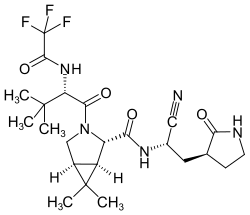 | |||||||||||||
| Allgemeines | |||||||||||||
| Freiname | Nirmatrelvir (vorgeschlagener Freiname[1]) | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C23H32F3N5O4 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Arzneistoffangaben | |||||||||||||
| Wirkstoffklasse | |||||||||||||
| Wirkmechanismus |
Hemmung der viralen 3C-like-Protease (3CLpro) | ||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 499,53 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Nirmatrelvir wurde – in Kombination mit Ritonavir, unter dem Handelsnamen Paxlovid – von dem Pharmaunternehmen Pfizer klinisch entwickelt.[3] Am 22. Dezember 2021 erhielt das Kombinationsmedikament in den USA eine Notfallzulassung,[4] am 31. Dezember 2021 in Großbritannien und am 28. Januar 2022 in der EU eine bedingte Zulassung. Es ist das erste zugelassene COVID-19-Mittel, das oral verabreicht werden kann.
Eigenschaften
Im April 2021 stellte Pfizer das Molekül auf einer Tagung der American Chemical Society vor.[5] Die Struktur enthält als biologisch aktiven Teil („warhead“) eine Nitrilgruppe, die mit dem Cystein-Rest der katalytischen Diade im aktiven Zentrum der 3CLpro reagiert. Die Struktur wurde durch entsprechende chemische Modifikationen für eine orale Verabreichung optimiert.[6] Die orale Gabe als Kapsel oder Tablette ermöglicht die Behandlung von SARS-CoV-2-Infizierten in der Frühphase, wenn die Viruslast besonders hoch ist, aber noch kaum Symptome auftreten und eine Hospitalisierung nicht oder noch nicht erforderlich ist.[7]
In den bisherigen klinischen Studien wird Nirmatrelvir zusammen mit einer geringen Dosis des bereits für die antiretrovirale Therapie zugelassenen HIV-Proteaseinhibitors Ritonavir verabreicht. Die gleichzeitige Verabreichung trägt dazu bei, den Abbau von Nirmatrelvir zu verlangsamen, damit es im Körper für längere Zeit in höheren Konzentrationen aktiv bleiben kann, um so die Bekämpfung des Virus zu unterstützen.[8] Ritonavir ist ein Inhibitor des Cytochrom-P450-Systems in der Leber.
Hintergrund
Die 3-Chymotrypsin-like protease (3CLpro; auch: Nichtstrukturprotein 5, nsp5) ist beteiligt an der posttranslationalen Verarbeitung verschiedener Polypeptide und an der Produktion von 16 Nichtstrukturproteinen des SARS-CoV-2 („Corona-Virus“). Diese Nichtstrukturproteine spielen eine grundlegende Rolle bei der Replikation, Transkription und Virusrekombination während einer Infektion. Die Hemmung von Proteasen blockiert die Freisetzung von Nichtstrukturproteinen und unterdrückt die Reifung und Infektiosität von SARS-CoV-2. Infolgedessen ist 3CLpro als Hauptprotease von SARS-CoV-2 ein attraktives Ziel für die Entwicklung antiviraler Wirkstoffe gegen COVID-19.[9]
Klinische Prüfung
PF-07321332 (Nirmatrelvir) befindet sich noch in der klinischen Entwicklung. In drei ersten Phase-1-Studien wurde PF-07321332 ausschließlich intravenös verabreicht,[10][11][12] ebenso in einer Phase-3-Studie mit hospitalisierten Patienten (250 mg pro Tag über 5 Tage).[13] Von Juli bis September 2021 wurden drei Phase-3-Studien aufgelegt, in denen nicht hospitalisierte mit SARS-CoV-2 Infizierte PF-07321332 in Kombination mit Ritonavir als orale Gabe erhalten (alle 12 Stunden für fünf Tage):[14][15][16]
- EPIC-HR (Evaluation of Protease Inhibition for COVID-19 in High-Risk Patients),
- EPIC-SR (Evaluation of Protease Inhibition for COVID-19 in Standard-Risk Patients) und
- EPIC-PEP (Evaluation of Protease Inhibition for COVID-19 in Post-Exposure Prophylaxis)
EPIC-HR
Am 5. November 2021 veröffentlichte Pfizer erste Ergebnisse der Studie EPIC-HR. Danach hat Nirmatrelvir/Ritonavir „bei den meisten ambulanten Risikopatienten mit kurzer Symptomdauer einen schweren Verlauf mit Hospitalisierung oder Tod verhindert“. In der Patientengruppe, die innerhalb von drei Tagen nach dem Auftreten von Symptomen PF-07321332 in Kombination mit Ritonavir erhielt, wurde nur bei 3 von 389 Patienten (0,8 %) eine Hospitalisierung notwendig. In der Placebogruppe mit 385 Patienten dagegen waren es 27 Patienten (7,0 %). Während es in der Verumgruppe keinen Todesfall gab, waren es in der Placebogruppe sieben. Bei einem zweiten Studienarm, der die Behandlung mit PF-07321332 bzw. Placebo auf bis zu 5 Tage nach Beginn erster Symptome erweiterte, gab es in der Verumgruppe ebenfalls keinen Todesfall und in der Placebogruppe zehn. Nur 6 von 607 Patienten (1,0 %) in der Verumgruppe mussten hospitalisiert werden, in der Placebogruppe 41 von 612 (6,7 %).[17]
Im Dezember 2021 informierte Pfizer, dass die finalen Daten der EPIC-HR-Studie mit 2246 erwachsenen Hochrisikopatienten die Zwischenergebnisse vom November bestätigten: Demzufolge senkt die fünftägige Gabe von Paxlovid (Nirmatrelvir + Ritonavir) beginnend innerhalb von drei Tagen nach Symptombeginn das Risiko eines Krankenhausaufenthalts im Vergleich zu Placebo um 89 %. Begann die Behandlung innerhalb von fünf Tagen nach Symptombeginn (sekundärer Endpunkt), so war das Risiko eines Krankenhausaufenthalts um 88 % gegenüber Placebo erniedrigt. In beiden Studienarmen trat kein Todesfall in der Verumgruppe auf. In der Patientengruppe im Alter von 65 Jahren oder älter, einer der Bevölkerungsgruppen mit dem höchsten Risiko für Krankenhausaufenthalt oder Tod, betrug die relative Risikoreduktion für eine Krankenhauseinweisung 94 %. In der der EPIC-HR-Studie wurde auch eine starke Reduktion der Viruslast, die an 499 Patienten untersucht wurde, festgestellt.[18] Auch gegen die neue Omikron-Variante soll das Medikament wirksam sein.[19]
Nebenwirkungen
Aus den Studien ergaben sich als mögliche Nebenwirkungen von Paxlovid ein beeinträchtigter Geschmackssinn, Durchfall, Bluthochdruck und Muskelschmerzen (Myalgien). Die Anwendung von Paxlovid bei Menschen mit unkontrollierter oder nicht diagnostizierter HIV-1-Infektion kann zu einer HIV-1-Arzneimittelresistenz führen. Ritonavir kann zudem Leberschäden verursachen.[20][21][22]
EPIC-SR
Ferner berichtete Pfizer im Dezember 2021 auch über Zwischenergebnisse aus der laufenden EPIC-SR-Studie, in der Paxlovid an ungeimpften COVID-19-Patienten mit Standardrisiko (d. h. geringes Risiko für Krankenhausaufenthalt oder Tod) sowie an geimpften COVID-19-Patienten mit Risikofaktoren für einen schweren Verlauf untersucht wird. Hier vermochte das Mittel Krankenhauseinweisungen um 70 % (sekundärer Endpunkt) zu reduzieren. Ebenso wie bei der EPIC-HR-Studie wurde eine stärkere Verminderung der Viruslast beobachtet als in der Placebogruppe. Der neue primäre Endpunkt – selbstberichtete, anhaltende Linderung aller Symptome an vier aufeinanderfolgenden Tagen im Vergleich zu Placebo – wurde hingegen nicht erreicht.[18]
Zulassungsstatus
Die Europäische Arzneimittelagentur (EMA) gab am 16. Dezember 2021, nachdem Pfizer die endgültigen Daten einer klinischen Studie zur Wirksamkeit der Arzneimittelkombination Paxlovid (bestehend aus Nirmatrelvir-Tabletten mit 150 mg und Ritonavir-Tabletten mit 100 mg Wirkstoff[23]) vorgestellt hatte, eine Handreichung zum Einsatz von Paxlovid heraus. Diese sollte den Einsatz des Medikaments erleichtern, bereits bevor es offiziell zugelassen sei.[23] Demzufolge können die Tabletten „zur Behandlung von Erwachsenen mit COVID-19 eingesetzt werden, die keinen zusätzlichen Sauerstoff benötigen und bei denen ein erhöhtes Risiko eines schweren Krankheitsverlaufs besteht“.[24][25] Das offizielle Zulassungsverfahren für die EU begann am 10. Januar 2022.[26] Am 28. Januar 2022 erfolgte eine bedingte Zulassung,[27][28] nachdem die Europäische Arzneimittelagentur am Tag zuvor eine entsprechende Empfehlung[29] ausgesprochen hatte.
Die U.S. Food and Drug Administration erteilte am 22. Dezember 2021 eine Notfallzulassung für die Gabe von Paxlovid an Hochrisikopatienten mit nachgewiesener SARS-CoV-2 Infektion.[30] Die USA haben bereits 10 Millionen Dosen des Medikaments bestellt; die Auslieferung soll laut Präsident Joe Biden im Frühjahr 2022 beginnen.[19] Am 4. Januar 2022 wurde bekannt, dass die US-Regierung ihre Bestellung verdoppelt hat und für die 10 Millionen Packungen 5,3 Milliarden US-Dollar (530 $ pro Packung) bezahlte.[31]
Die britische Arzneimittelbehörde MHRA hat Paxlovid am 31. Dezember 2021 bedingt zugelassen. Es könne eingesetzt werden bei Menschen über 18 Jahren mit milden bis moderaten Symptomen, die ein Risiko für einen schweren Verlauf haben.[32][33]
Einzelnachweise
- INN Proposed List 126, World Health Organisation (WHO), 25. Januar 2022.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- S. Siebenand: Pfizers Paxlovid punktet. In: Pharmazeutische Zeitung (www.pharmazeutische-zeitung.de). 5. November 2021.
- AFP: Anti-Covid-Pille erhält Notfallzulassung in den USA. In: FAZ.net. 22. Dezember 2021, abgerufen am 23. Dezember 2021.
- B. Halford: Pfizer unveils its oral SARS-CoV-2 inhibitor. In: Chemical & Engineering News. 7. April 2021, abgerufen am 14. Juli 2021.
- K. Vandyck, J. Deval: Considerations for the discovery and development of 3-chymotrypsin-like cysteine protease inhibitors targeting SARS-CoV-2 infection. In: Current Opinion in Virology. Nr. 49, 2021, S. 36–40, doi:10.1016/j.coviro.2021.04.006.
- D. Hüttemann: Oraler Proteasehemmer gegen Corona geht in klinische Prüfung. In: www.pharmazeutische-zeitung.de. 3. April 2021.
- Pfizer’s Novel COVID-19 Oral Antiviral Treatment Candidate Reduced Risk of Hospitalization or Death by 89% in Interim Analysis of Phase 2/3 EPIC-HR Study. Pressemitteilung von Pfizer vom 5. November 2021.
- J. C. Ferreira, W. M. Rabeh: Biochemical and biophysical characterization of the main protease, 3-chymotrypsin-like protease (3CLpro) from the novel coronavirus SARS-CoV 2. In: Scientific Reports. Nr. 10. Nature, 2020, doi:10.1038/s41598-020-79357-0.
- Klinische Studie (Phase I): Single Ascending Dose Study of Intravenous Infusion of PF 07304814 in Healthy Adult Participants bei Clinicaltrials.gov der NIH
- Klinische Studie (Phase I): First-In-Human Study To Evaluate Safety, Tolerability, And Pharmacokinetics Following Single Ascending And Multiple Ascending Doses of PF-07304814 In Hospitalized Participants With COVID-19. bei Clinicaltrials.gov der NIH
- Klinische Studie (Phase I): Study to Investigate the Mass Balance, Metabolism, and Excretion of [14C]-PF-07304814 in Healthy Participants bei Clinicaltrials.gov der NIH
- Klinische Studie (Phase III): ACTIV-3: Therapeutics for Inpatients With COVID-19 bei Clinicaltrials.gov der NIH
- Klinische Studie (Phase III): A Study of PF-07321332/Ritonavir in Non hospitalized High Risk Adult Participants With COVID-19 bei Clinicaltrials.gov der NIH
- Klinische Studie (Phase III): A Study of PF-07321332/Ritonavir in Non-hospitalized Low-Risk Adult Participants With COVID-19 bei Clinicaltrials.gov der NIH
- Klinische Studie (Phase III): A Post-Exposure Prophylaxis Study of PF-07321332/Ritonavir in Adult Household Contacts of an Individual With Symptomatic COVID-19 bei Clinicaltrials.gov der NIH
- rme: COVID-19: Neuer Proteaseinhibitor verhindert Hospitalisierung oder Tod in Phase-2/3-Studie. In: aerzteblatt.de. 5. November 2021, abgerufen am 6. November 2021.
- Pfizer Announces Additional Phase 2/3 Study Results Confirming Robust Efficacy of Novel COVID-19 Oral Antiviral Treatment Candidate in Reducing Risk of Hospitalization or Death. Pressemitteilung Pfizer, 14. Dezember 2021, abgerufen am 18. Dezember 2021.
- Spencer Kimball: FDA authorizes Pfizer's Covid treatment pill, the first oral antiviral drug cleared during the pandemic. 22. Dezember 2021, abgerufen am 23. Dezember 2021 (englisch).
- Coronavirus (COVID-19) Update: FDA Authorizes First Oral Antiviral for Treatment of COVID-19 FDA, 22. Dezember 2021.
- Tagesschau-Beitrag zu Paxlovid, abgerufen am 23. Dezember 2021.
- E. Mahase: News Covid-19: Pfizer’s paxlovid is 89% effective in patients at risk of serious illness, company reports. BMJ 2021 doi: https://doi.org/10.1136/bmj.n2713
- Covid-19-Mittel von Pfizer: EMA empfiehlt Paxlovid bereits vor der Zulassung, www.pharmazeutische-zeitung.de, 16. Dezember 2021.
- EMA issues advice on use of Paxlovid (PF-07321332 and ritonavir) for the treatment of COVID-19. 16. Dezember 2021, abgerufen am 18. Dezember 2021.
- EMA unterstützt Einsatz von Paxlovid für Notfälle. In: aerzteblatt.de. 17. Dezember 2021, abgerufen am 18. Dezember 2021.
- EMA receives application for conditional marketing authorisation for Paxlovid (PF-07321332 and ritonavir) for treating patients with COVID-19 European Medicines Agency, 10. Januar 2022.
- Eintrag EU/1/22/1625 im Union Register of medicinal products for human use. 28. Januar 2022.
- Paxlovid – EPAR, Europäische Arznimiettelagentur (EMA), 28. Januar 2022.
- Deutscher Ärzteverlag GmbH, Redaktion Deutsches Ärzteblatt: Europäische Arzneimittelagentur empfiehlt Marktzulassung für Paxlovid. 27. Januar 2022, abgerufen am 28. Januar 2022.
- Frequently Asked Questions on the Emergency Use Authorization for Paxlovid for Treatment of COVID-19. FDA, 22. Dezember 2021, abgerufen am 22. Dezember 2021 (englisch).
- tagesschau.de, 4. Januar 2022.
- Oral COVID-19 antiviral, Paxlovid, approved by UK regulator, Pressemitteilung MHRA, 31. Dezember 2021.
- UK medicines regulator approves second Covid antiviral pill, BBC News, 31. Dezember 2021.