Nenitzescu-Indolsynthese
Die Nenitzescu-Indolsynthese ist eine Namensreaktion der organischen Chemie. Sie wird auch Nenitzescu-Reaktion, Nenitzescu-Synthese, Nenitzescu-Cyclisierung oder Nenitzescu-Kondensation genannt. Diese Reaktion wurde nach dem rumänischen Chemiker Costin Nenitzescu (1902–1970)[1] benannt, der sie 1929 veröffentlichte.[2][3] Mit der Reaktion lassen sich 5-Hydroxyindole aus 1,4-Benzochinon und β-Amino-α,β-ungesättigten Carbonylverbindungen (z. B. β-Aminocrotonsäureestern) synthetisieren.[4][5][6][7]
Übersichtsreaktion
Ein substituiertes 1,4-Benzochinon reagiert mit einer β-aminosubstituierten-α,β-ungesättigten Carbonylverbindungen unter Ringschluss zu einem 5-Hydroxyindol.
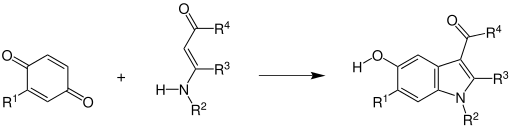 R1 = H, Alkylgruppe, Arylgruppe; R2 = H, Alkylgruppe, Arylgruppe; R3 = H, Alkylgruppe; R4 = H, Alkylgruppe, Alkoxygruppe[3][8]
R1 = H, Alkylgruppe, Arylgruppe; R2 = H, Alkylgruppe, Arylgruppe; R3 = H, Alkylgruppe; R4 = H, Alkylgruppe, Alkoxygruppe[3][8]
Die Reaktion funktioniert auch mit an das Benzochinon substituierten Alkoxy-, Aryloxy-, Hydroxygruppen sowie Chlor-, Brom- oder Estersubstituenten. Für die anderen Reste sind die folgenden Gruppen zulässig:[8]
- R2 = Cycloalkyl-, Benzylgruppen
- R3 = Alkylester, Alkoxygruppen
- R4 = Aryl- und Aminogruppen
Mechanismus
Der exakte Reaktionsmechanismus ist nicht bekannt. Ein plausibler Mechanismus wird hier anhand der Reaktion zwischen 2-Methyl-1,4-benzochinon und β-Aminoacrylsäuremethylester beschrieben:[3][8][9]
 Mechanismus der Nenitzescu-Indolsynthese
Mechanismus der Nenitzescu-Indolsynthese
Im ersten Schritt greift die C=C-Doppelbindung des β-Aminoacrylsäuremethylester (2) das 2-Methyl-1,4-benzochinon (1) an, was zu Molekül 3 führt. Ein Proton wird zur Alkoholatgruppe 3 umgelagert, was auch dazu führt, dass aus dem Iminiumion 3 wieder eine Aminogruppe 4 wird. Letztere greift nun intramolekular die Carbonylgruppe des Benzochinons an, was die Bildung eines Fünfrings 5 zur Folge hat. Das entstandene negativ gelagene Sauerstoffatom wird durch die Ammoniumgruppe protoniert und damit zur Hydroxygruppe 6. Unter Wasserabspaltung aromatisiert der Sechsring zum Produkt 7, einem 5-Hydroxy-6-methyl-3-methylcarboxylat-1H-indol.[3][8][6]
Diese Reaktion ist besonders wichtig bei der Herstellung von 5-Hydroxyindolderivaten.[3]
Einzelnachweise
- Sorin Rosca: COSTIN D. NENITESCU. 2002, abgerufen am 5. Juni 2013.
- C. D. Nenitzescu: Nenitzescu indole synthesis. In: Bull. Soc. Chim. Romania. Band 11, 1929, S. 37.
- Z. Wang: Comprehensive Organic Name Reactions and Reagents. 3 Bände. John Wiley & Sons, Hoboken, New Jersey 2009, ISBN 978-0-471-70450-8, S. 2042–2043.
- G. Domschke: Die 5-Hydroxy-indolsynthese nach C. D. Nenitzescu. In: Zeitschrift für Chemie. Band 6, Nr. 2, 1966, S. 41–51, doi:10.1002/zfch.19660060202.
- S. A. Monti: The Nentizescu Condensation of Ethyl 3-Aminocrotonate and 1,4-Benzoquinone. In: J. Org. Chem. Band 31, Nr. 8, 1966, S. 2669–2672, doi:10.1021/jo01346a503.
- J. J. Li: Name Reactions. A Collection of Detailed Reaction Mechanisms. 3. erweiterte Auflage, Springer-Verlag, Berlin, Heidelberg 2006, ISBN 978-3-540-30030-4, S. 391–392.
- D. M. Ketcha, L. J. Wilson, D. E. Portlock: The solid-phase Nenitzescu indole synthesis. In: Tetrahedron Letters. Band 41, Nr. 33, 2000, S. 6253–6257, doi:10.1016/S0040-4039(00)00697-3.
- L. Kürti, B. Czakó: Stratigic Applications of Named Reactions in Organic Synthesis. Elsevier Academic Press, Amsterdam 2005, ISBN 978-0-12-429785-2, S. 312.
- R. Littell, G. O. Morton, G. R. Allen: Observations on the mechanism of the nenitzescu indole synthesis. In: J. Chem. Soc. D. Band 19, 1969, S. 1144–1144, doi:10.1039/C29690001144.