Natriumtetrachloroaurat(III)
Natriumtetrachloroaurat, Na[AuCl4] ist das Natrium-Salz der Tetrachlorogoldsäure.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
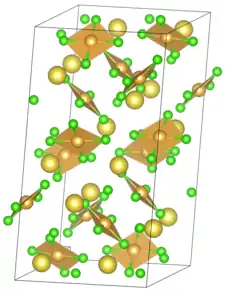 | ||||||||||||||||
| _ Na+ _ Au3+ _ Cl− | ||||||||||||||||
| Kristallsystem | ||||||||||||||||
| Raumgruppe |
P21/n (Nr. 14, Stellung 2) | |||||||||||||||
| Gitterparameter |
| |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Natriumtetrachloroaurat(III) | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Verhältnisformel | Na[AuCl4] | |||||||||||||||
| Kurzbeschreibung |
kristalliner Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 361,756 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
0,8 g·cm−3 (20 °C)[2] | |||||||||||||||
| Schmelzpunkt |
zersetzt sich ab 100 °C[2] | |||||||||||||||
| Löslichkeit |
löslich in Wasser[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Das Dihydrat von Natriumtetrachloroaurat kann durch Reaktion einer sauren Lösung von Gold(III)-chlorid oder Tetrachlorogoldsäure mit Natriumchlorid gewonnen werden.[3]
Eigenschaften
Natriumtetrachloroaurat ist ein kristalliner Feststoff, welcher sich bei 100 °C zersetzt. In Wasser ist er löslich.[2] Das Salz kristallisiert in einem monoklinen Kristallsystem mit Raumgruppe P21/n (Raumgruppen-Nr. 14, Stellung 2). Die Gitterparameter sind a = 11,277 Å, b = 11,234 Å, c = 20,584 Å und Z = 12. Die Gradzahl des β-Winkels beträgt 104,58°. Der Abstand des Gold und dem Chlor ist 2,277 Å und der des Natriums und dem Chlor liegt zwischen 2,82 Å und 3,19 Å.[4]
Verwendung
Natriumtetrachloroaurat wird in Chemotherapeutika und als Katalysator bei der Entfernung von tert-Butyl(dimethyl)silyl (TBS)-Schutzgruppen eingesetzt. Es ist selektiv in Gegenwart von aromatischen TBS-Ethern, aliphatischen Triisopropylsilylethern, aliphatischen tert-Butyl(diphenyl)silylethern oder sterisch gehinderten aliphatischen TBS-Ethern. Mit überschüssigem Katalysator können TBS-Ether auch in 4-Methoxybenzylethern oder Methylethern umgewandelt werden.[2]
Sicherheitshinweise
Der Stoff verursacht schwere Verätzungen der Haut und hinterlässt schwere Augenschäden. Beim Verschlucken wirkt es gesundheitsschädlich, da es zu Verätzungen des Mundraumes und Rachens, sowie zur Perforation der Speiseröhre und des Magens führen kann.[2]
Im Brandfall kann Chlorwasserstoff, Natriumoxid und Goldoxide entstehen. Mit Basen, Oxidationsmitteln, Ammoniak und Metallen kann es zu heftigen Reaktionen kommen.[2]
Literatur
- Datenblatt Sodium tetrachloroaurate(III) hydrate bei Sigma-Aldrich, abgerufen am 8. Februar 2019 (PDF).
- Datenblatt Natriumgoldchlorid bei Wieland Edelmetalle, abgerufen am 8. Februar 2019.
Einzelnachweise
- Brockhaus Enzyklopädie in zwanzig Bänden. Brockhaus, 1969, ISBN 3-7653-0322-4, S. 460 (eingeschränkte Vorschau in der Google-Buchsuche).
- Datenblatt Sodium tetrachloroaurate(III) dihydrate bei AlfaAesar, abgerufen am 8. Februar 2019 (PDF) (JavaScript erforderlich).
- A. P. Hagen: Inorganic Reactions and Methods, The Formation of Bonds to Halogens. John Wiley & Sons, 2009, ISBN 978-0-470-14539-5, S. 102 (eingeschränkte Vorschau in der Google-Buchsuche).
- P. G. Jones, R. Hohbein, E. Schwarzmann: Anhydrous sodium tetrachloroaurate(III). Acta Cryst., 1988, S. 1164–1166, doi:10.1107/S0108270188002756.

