Natriumphenylbutyrat
Natriumphenylbutyrat, das Natriumsalz der 4-Phenylbuttersäure, ist eine chemische Verbindung aus der Gruppe der Natriumsalze aromatischer kurzkettiger Fettsäuren. Sie wird als Arzneistoff zur Behandlung von Hyperammonämie (zu hoher Ammoniumgehalt im Blut), besonders von angeborenen Störungen des Harnstoffzyklus wie Harnstoffzyklusdefekt, eingesetzt.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
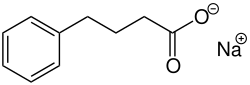 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Natriumphenylbutyrat | |||||||||||||||||||||
| Andere Namen |
Natrium(4-phenylbutanoat) | |||||||||||||||||||||
| Summenformel | C10H11NaO2 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
A16AX03 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 186,2 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Stoffwechsel
Das im Darm gut resorbierbare Phenylbutyrat wird beim Menschen mittels der β-Oxidation (Kurzkettenacyl-CoA Dehydrogenase, SCAD) zu Phenylacetat abgebaut. Phenylacetat kann dann in der Leber an die Aminosäure Glutamin gekoppelt werden, wodurch Phenylacetylglutamin entsteht, das gut wasserlöslich ist und mit dem Urin ausgeschieden werden kann.[2] Das Konjugationsprodukt wird innerhalb von 24 Stunden zu etwa 80–100 % mit dem Urin ausgeschieden.[3]
Pro 1 Mol verabreichten Phenylbutyrats werden maximal 2 Mol Stickstoff ausgeschieden.[4]
Eigenschaften
Neben der Wirkung von Phenylbutyrat durch Konjugatbildung seines Metaboliten Phenylacetat im Rahmen der Stickstoffelimination aus dem Körper sind Funktionen sowohl als Enzyminhibitor (z. B. Hemmung der Histondeacylase)[5] als auch als Chaperon[6] bekannt.
Verwendung in der Humanmedizin
Die Eliminierung von Ammoniak mittels Phenylbutyrat wird bei Patienten mit Hyperammonämien, vorwiegend bei Patienten mit angeborenen Harnstoffzyklusdefekten, eingesetzt.[2] Natriumphenylbutyrat ist unter dem Namen Ammonaps als Medikament zur Behandlung von Patienten mit Harnstoffzyklusstörungen zugelassen. Als Dosierungen sind empfohlen:
- 450–600 mg/kg/Tag für Neugeborene, Säuglinge und Kinder < 20 kg Körpergewicht.
- 9,9–13,0 g/m²/Tag für Kinder > 20 kg Körpergewicht, Jugendliche und Erwachsene.[3]
Schwangerschaft, Stillzeit, Leber- und/oder Niereninsuffizienz sowie Überempfindlichkeit gegen den Wirkstoff stellen Kontraindikationen für Phenylbutyrat dar.[3]
Die biologische Halbwertszeit von Natriumphenylbutyrat beträgt etwa 0,8 Stunden.[3]
Bei der Anwendung von Natriumphenylbutyrat ist zu beachten, dass es sich um eine Natriumverbindung handelt und deshalb mit dem Medikament zu berücksichtigende Mengen an Natrium zugeführt werden (Vorsicht bei Herz- und Niereninsuffizienz).[3]
Andere Indikationen
Natriumphenylbutyrat hemmt in einigen Fällen das Tumorwachstum und zeigt seine Wirkung wegen seiner guten Liquorgängigkeit besonders bei Hirntumoren (z. B. Astrozytomen). Erfolge zeigten sich aber auch in der Behandlung von Prostata- und anderen Krebsarten.[7] Behandlungsversuche sind zusätzlich bei spinaler Muskelatrophie, amyotropher Lateralsklerose, Sichelzellenanämie und bei Thalassämien, Mukoviszidose sowie bei Morbus Huntington, bei angeborem Defekt der Pyruvatdehydrogenase und auch bei der Alzheimer-Krankheit durchgeführt worden bzw. sind noch nicht abgeschlossen.[7][8][9][10] Zur Behandlung seltener Krankheiten wie der 5q-spinalen Muskelatrophie, Citrullinämie Typ I (=Argininosuccinat-Synthase-Mangel), Carbamylphosphatsynthetase-Mangel und Ornithintranscarbamylase-Mangel hat Natriumphenylbutyrat den Status eines Orphan-Arzneimittels.[11]
Nebenwirkungen
Generell wird Natriumphenylbutyrat gut vertragen. Allerdings kann es nach Gabe von Phenylbutyrat zu Nebenwirkungen kommen. An erster Stelle steht das Auftreten von Amenorrhöen bzw. Dysmenorrhöen, gefolgt von Beeinträchtigungen der Blutbildung, Magen-Darm-Beschwerden, Müdigkeit, u. a.[3]
Bei zu hoher Dosierung von Phenylbutyrat (z. B. 1000 mg/kg Körpergewicht und Tag) kann es zu Durchfällen, Elektrolytverschiebungen (Hypokaliämie) mit oder ohne Ödembildung und zur metabolischen Acidose kommen.[3] Ein Großteil des resorbierten Phenylbutyrates wird dann unverstoffwechselt wieder ausgeschieden.[12]
Bei Langzeittherapie ist zu beachten, dass es durch die permanente Bindung von Glutamin im Körper zur vermehrten Synthese von Glutamat und Glutamin kommt, was zu Lasten vor allem der essentiellen verzweigtkettigen Aminosäuren einhergeht, bei denen sich dann ein Mangel entwickeln kann.
Interaktionen
Werden Natriumphenylbutyrat und Probenecid (Arzneistoff zur Behandlung der Hyperurikämie) gleichzeitig verabreicht, kann die Ausscheidung von Phenylacetylglutamat verändert werden.[3] Die gemeinsame Gabe von Natriumbenzoat (auch zur Behandlung der Hyperammonämie) und Phenylbutyrat in hohen Dosen kann zur Bildung von Phenylacetylbenzoat führen und beide Substanzen stehen zur Ammoniakeliminierung dann nicht mehr zur Verfügung.[12]
Fertigarzneimittel
Ammonaps (EU), Pheburane (EU), Buphenyl (USA)
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- M. L. Batshaw, R. B. MacArthur, M. Tuchman: Alternative pathway therapy for urea cycle disorders: twenty years later. In: J Pediatr. 138 (1 Suppl), 2001, S. 46–54.
- Zusammenfassung der Merkmale des Arzneimittels Ammonaps (SOBI, Swedish Orphan Biovitrum International) bei der EMA.
- S. W. Brusilow: Phenylacetylglutamine may replace urea as a vehicle for waste nitrogen excretion. In: Pediatr Res. 29, 1991, S. 147–150.
- A. G. Kazantsev, L. M. Thompson: Therapeutic application of histone deacetylase inhibitors for central nervous system disorders. In: Nat Rev Drug Discov. 7, 2008, S. 854–868. PMID 18827828.
- U. Ozcan, E. Yilmaz, L. Ozcan, M. Furuhashi, E. Vaillancourt, R. O. Smith, C. Z. Görgün, G. S. Hotamisligil: Chemical chaperones reduce ER stress and restore glucose homeostasis in a mouse model of type 2 diabetes. In: Science. 313, 2006, S. 1137–1140.
- T. Iannitti, B. Palmieri: Clinical and experimental applications of sodium phenylbutyrate. In: Drugs R D. 11, 2011, S. 227–249. PMID 21902286.
- R. Ferriero, G. Manco, E. Lamantea, E. Nusco, M. I. Ferrante, P. Sordino, P. W. Stacpoole, B. Lee, M. Zeviani, N. Brunetti-Pierri: Phenylbutyrate therapy for pyruvate dehydrogenase complex deficiency and lactic acidosis. In: Sci Transl Med. 5, 2013, S. 175. PMID 23467562.
- M. Cuadrado-Tejedor, A. García-Osta, A. Ricobaraza, J. Oyarzabal, R. Franco: Defining the mechanism of action of 4-phenylbutyrate to develop a small-molecule-based therapy for Alzheimer's disease. In: Curr Med Chem. 18, 2011, S. 5545–5553.
- A. L. Ricobaraza, R. Torrijo, R. Franco, A. Garcia-Osta: Phenylbutyrate is a multifaceted drug that exerts neuroprotective effects and reverses the Alzheimer’s disease-like phenotype of a commonly used mouse model. In: Curr Pharm Des. 19, 2013, S. 5076–5084. PMID 23448463.
- Register of designated Orphan Medicinal Products of the European Commission
- E. Mönch: Defekte des Harnstoffzyklus – Klinische Bedeutung und Therapie. 2. Auflage. UNI-Med-Verlag, Bremen 2011, ISBN 978-3-8374-1309-0.