Morbus Basedow
Morbus Basedow (auch Morbus Basedowii, von lateinisch morbus „Krankheit“), Basedowsche Krankheit oder Graves-Krankheit (englisch Graves’ disease) ist eine auch Immunhyperthyreose genannte Autoimmunerkrankung der Schilddrüse. Die Erkrankung führt zu einer übermäßigen Produktion von Schilddrüsenhormonen (Schilddrüsenüberfunktion, Hyperthyreose) und geht häufig mit einer Schilddrüsenvergrößerung (Struma) oder einer Beteiligung der Augen (endokrine Orbitopathie) einher.
| Klassifikation nach ICD-10 | |
|---|---|
| E05.0 | Hyperthyreose mit diffuser Struma - Basedow-Krankheit (Morbus Basedow) |
| ICD-10 online (WHO-Version 2019) | |
Während die Erkrankung in einem Teil der Fälle unter einer überbrückenden medikamentösen Therapie innerhalb von ein bis anderthalb Jahren von selbst wieder zum Stillstand kommt (Remission), ist in der Mehrzahl der Fälle eine Behandlung mittels Operation (Strumaresektion) oder radioaktiver Therapie (Radiojodtherapie) notwendig.
Synonyme
Im deutschen Sprachraum wird die Erkrankung nach dem deutschen Erstbeschreiber Carl Adolph von Basedow (1840) benannt. Im englischsprachigen Raum wird die Krankheit nach dem irischen Erstbeschreiber Robert James Graves (1835) als Graves’ disease bezeichnet. Weitere Bezeichnungen sind Autoimmunthyreopathie Typ 3, Immunthyreopathie oder Immunhyperthyreose (IHT). Die Basedow-Krankheit ist außerdem unter den Bezeichnungen Begbie’s disease, Flajani’s disease, Flajani-Basedow syndrome, Marsh’s disease oder Parry’s disease in der Literatur bekannt.[1]
Geschichte

Erste Beschreibungen der Erkrankung stammen von Giuseppe Flajani[2] (1802), Caleb Hillier Parry (1825) und R. J. Graves (1835). Der in Merseburg tätige Arzt Carl von Basedow beschrieb 1840 die später als Merseburger Trias bekannte Symptomkonstellation aus Exophthalmus, Kropf und Tachykardie.[3][4] Er deutete sie als „maskierte skrofulöse Dyskrasie des Blutes“ (Dyskrasie: nach Hippokrates falsche Zusammensetzung der Körpersäfte). Er behandelte das Syndrom mit jodhaltigem Mineralwasser.[5] Robert James Graves hatte diese Symptomkombinaton bereits 1835 beschrieben und sie als Krankheit des Herzens interpretiert.[6] Im Jahr 1886 wies Paul Julius Möbius den Bezug des Syndroms zu einer Überfunktion der Schilddrüse nach.[5]
Zu den Chirurgen, die sich mit der Basedowschen Krankheit befassten, gehörten Theodor Billroth, der ab 1862 größere Kropfoperationen[7] durchführte, Theodor Kocher, der 1883 den Zusammenhang von Strumaresektion und folgender Hypothyreose publizierte (und 1909 den Nobelpreis für seine Schilddrüsenforschung erhielt),[8] sowie zu Beginn des 20. Jahrhunderts Johann von Mikulicz und Ferdinand Sauerbruch in Breslau.[9]
1942 wendeten S. Hertz und A. Roberts erstmals die Radiojodtherapie beim Morbus Basedow an.[10][11] Edwin B. Astwood beschrieb 1943 die Therapie der Erkrankung mit dem Thyreostatikum 2-Thiouracil.[12]
Verbreitung
Zur Häufigkeit (Prävalenz) des Morbus Basedow in Deutschland gibt es keine genauen Angaben. Für Länder mit ausreichender Jodversorgung wird die Häufigkeit bei Frauen mit zwei[13] bis drei Prozent angegeben, für Männer mit ungefähr einem Zehntel davon. Die jährliche Neuerkrankungsrate (Inzidenz) liegt bei einem auf 1000 Einwohner.[14]
Der Morbus Basedow betrifft häufig Frauen im gebärfähigen Alter. Die Erkrankung kann in jedem Lebensalter auftreten, ein Drittel der Fälle findet sich vor dem 35. Lebensjahr, das Maximum liegt zwischen dem 20. und 40. Lebensjahr. In Ländern mit guter Jodversorgung (wie beispielsweise den USA) ist der Morbus Basedow mit über 95 % der Fälle die häufigste Ursache für eine Hyperthyreose, in Ländern mit schlechter Jodversorgung ist dagegen die Schilddrüsenautonomie häufiger. Das gleichzeitige Auftreten von Morbus Basedow und Schilddrüsenautonomie heißt Marine-Lenhart-Syndrom; die Häufigkeit wird (für Patienten mit Morbus Basedow) mit einem Prozent angegeben.[15][16]
Schon Neugeborene können im Falle eines Morbus Basedow bei der Mutter eine Hyperthyreose und eine Struma aufweisen, weil die auslösenden Immunglobuline (TSH-Rezeptorautoantikörper) plazentagängig sind. Bei eigener manifester Erkrankung nach der Neugeborenenphase sind das Wachstum und die Knochenalterung beschleunigt.[17]
Pathophysiologie
Dem Morbus Basedow liegen mehrere Faktoren zu Grunde. Zum einen findet sich ein genetisch festgelegter Defekt des Immunsystems, zum anderen wird dieser durch bestimmte äußere Einflüsse verstärkt (psychosozialer bzw. emotionaler oder körperlicher Stress, Umwelteinflüsse (Rauchen), (Virus-)Infektionen); spezifische Auslöser sind allerdings nicht bekannt.[18][17] Letztlich bricht die Selbsttoleranz gegenüber Antigenen der Schilddrüse zusammen, es resultiert eine Autoimmunkrankheit.
Die vom Körper gegen das Schilddrüsengewebe gebildeten Autoantikörper (Immunglobuline der IgG-Klasse[17]) binden an den Rezeptor für das Thyreotropin (Thyreoidea-stimulierendes Hormon, TSH). TSH ist das Hormon, das von der Hypophyse (Hirnanhangdrüse) im Rahmen des thyreotropen Regelkreises gebildet wird.
Die TSH-Rezeptor-Antikörper (TRAK) haben eine intrinsische Aktivität am TSH-Rezeptor und stimulieren daher die Follikelepithelzellen der Schilddrüse. Die Jodaufnahme in die Schilddrüse wird gesteigert, die Schilddrüsenhormone Trijodthyronin (T3) und Thyroxin (T4) werden vermehrt produziert und vermehrt ausgeschüttet. Es entsteht eine Schilddrüsenüberfunktion (Hyperthyreose). Das Wachstum der Schilddrüse wird angeregt, weshalb oft eine Größenzunahme der Schilddrüse (Struma) resultiert.
Es kommen aber auch TSH-Rezeptor-Antikörper ohne stimulierende Wirkung und solche mit blockierender Wirkung vor. Eine Änderung in der mengenmäßigen Zusammensetzung dieser Antikörper führt zu Änderungen im klinischen Verlauf der Erkrankung.
Das histopathologische Zeichen der Erkrankung sind lymphozytäre Infiltrate in der Schilddrüse, aber auch in den Augenmuskeln und im Subkutangewebe.[18][15]
Der Morbus Basedow ist mit dem Antigen HLA-DR3 assoziiert.[18] Als HLA-DR3-assoziierte Autoimmunerkrankung kommt er gehäuft zusammen mit anderen Autoimmunerkrankungen vor, wie Diabetes mellitus Typ1, Typ-A-Gastritis, Myasthenia gravis, Lupus erythematodes, Morbus Werlhof, Vitiligo, Morbus Addison und chronischer Polyarthritis.[18][15]
Es gibt Hinweise, dass ein bestimmter Genotyp (MICA A5.1/A5.1) den Ausbruch der Erkrankung begünstigt, während ein anderer Genotyp (MICA A6/A9) sich eher schützend auswirkt.[19]
Klinisches Bild
Der Morbus Basedow manifestiert sich an der Schilddrüse und außerhalb der Schilddrüse. Der Zeitpunkt des Beginns der Beschwerden wird von den Patienten oft recht genau angegeben und fällt typischerweise mit äußeren Belastungen (zum Beispiel Prüfungen, Todesfälle in der Umgebung oder besondere berufliche Belastungen) zusammen.[15]
An der Schilddrüse bewirken die Autoantikörper eine Schilddrüsenüberfunktion (Hyperthyreose) und eine Schilddrüsenvergrößerung (Struma).
Typische Beschwerden bei Hyperthyreose sind Schlaflosigkeit, Gereiztheit, Nervosität und Zittern (feinschlägiger Tremor), Sinustachykardie, Extrasystolen, Vorhofflimmern, Gewichtsverlust trotz Heißhunger, Wärmeintoleranz, Schweißausbrüche, warme feuchte Haut, gesteigerte Stuhlfrequenz, Schwäche der Muskulatur, Osteoporose und Zyklusstörungen bis hin zu vorübergehender Unfruchtbarkeit.[18][17][20]
Bei deutlicher Struma klagen die Patienten häufig über ein Druck-, Enge- oder Kloßgefühl im Hals, Missempfindungen beim Tragen enger Kragen, Schluckbeschwerden oder Luftnot bei Belastung.[15]
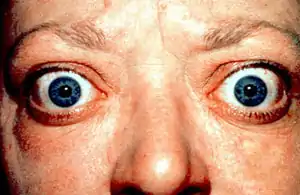
Häufigste Manifestationsform des Morbus Basedow außerhalb der Schilddrüse ist die endokrine Orbitopathie (EO), die sich in der auffälligsten Verlaufsform als Hervortreten der Augäpfel (Exophthalmus) präsentieren kann. Beim Blick nach unten bleibt, wie der Berliner Augenarzt Albrecht von Graefe beobachtet hatte, das obere Augenlid zurück (Gräfe-Zeichen).[21] Die Angaben zur Häufigkeit der EO schwanken. Bei subtiler Diagnostik (Ultraschall, Kernspintomographie, Erfassung der Augenbewegungen) kann bei nahezu allen Patienten mit Morbus Basedow eine subklinische EO festgestellt werden.[22] Sie tritt in etwa 60 % der Fälle gemeinsam mit der Hyperthyreose auf, seltener erst während der Therapie und sehr selten noch vor der Schilddrüsenüberfunktion. Ursächlich für die endokrine Orbitopathie werden gemeinsame Antigene des Orbitagewebes mit dem Schilddrüsengewebe vermutet.[15] Dabei aktivieren einwandernde Lymphozyten vorhandene Fibroblasten, wodurch es zu einer Anhäufung von Mucopolysacchariden kommt, die für Ödembildung und Verdickung des hinter den Augen gelegenen Fett- und Muskelgewebes verantwortlich sind. Die gleichen Ursachen werden auch für das prätibiale Myxödem als weiterer Manifestationsform angenommen, dessen Häufigkeit mit zwei bis drei Prozent angegeben wird.[18] Die Akropachie (Knochenneubildung an den Fingerendgelenken) ist ein sehr seltenes Phänomen bei Morbus Basedow.[23]
Diagnose und Befund
Die Diagnose „Morbus Basedow“ kann oft schon aus dem typischen Beschwerdebild (Schilddrüsenüberfunktion mit Augenbeteiligung) gestellt werden.

Im Ultraschall zeigt sich beim Morbus Basedow eine Echoarmut des Schilddrüsengewebes bei deutlicher Ungleichmäßigkeit („Inhomogenität“) und meist erhöhtem Volumen. Die Doppler-Sonografie zeigt eine vermehrte Durchblutung der gesamten Schilddrüse als Ausdruck der Entzündung und des gesteigerten Stoffwechsels. In der Schilddrüsenszintigrafie findet sich – bedingt durch die Stimulation der Schilddrüsenzellen am TSH-Rezeptor – eine erhöhte Aufnahme (uptake) des Tracers; in der Regel liegt der Technetium-uptake über 5 % (normal: 0,5 bis 2 %).
In den meisten Fällen bestätigen die Laborergebnisse die Diagnose: fT4 und fT3 im Serum sind erhöht, das TSH ist im thyreotropen Regelkreis entsprechend erniedrigt. Positive TSH-Rezeptor-Autoantikörper (TRAK) sind beweisend für den Morbus Basedow. Bei negativen TRAK können ersatzweise auch positive TPO-Ak oder Tg-Ak die Diagnose stützen. Nur extrem selten findet sich eine Autoimmunhyperthyreose mit negativem Autoantikörper-Status und fehlenden Zeichen der endokrinen Orbitopathie.
Differenzialdiagnose
In der differenzialdiagnostischen Abgrenzung zur Hyperthyreose bei Schilddrüsenautonomie sprechen der plötzliche Beginn, das Vorliegen von endokriner Orbitopathie oder Myxödem, eine eher diffuse Struma und junges Alter für einen Morbus Basedow, während ein schleichender Beginn der Hyperthyreose-Beschwerden, Fehlen von Augenbeschwerden, Vorhandensein von Schilddrüsenknoten und höheres Alter eher bei der Autonomie zu finden sind.
Auch eine Thyreoiditis de Quervain kann mit einer hyperthyreoten Laborkonstellation einhergehen, da aus zerstörten Zellen das Hormon freigegeben wird. Es finden sich im Gegensatz zum Morbus Basedow vor allem eine derbe schmerzhaft tastbare Schilddrüse, Fieber und Krankheitsgefühl. Daher sind diese Krankheiten in aller Regel bereits klinisch voneinander abzugrenzen. Eine erhöhte Blutkörperchensenkungsgeschwindigkeit, ein typisches sonografisches Bild und reduzierte Perfusion betroffener Areale im Ultraschall kennzeichnen die De Quervain-Thyreoiditis. Im Szintigramm fände man einen verminderten uptake.
Eine hyperthyreote Phase bei Hashimoto-Thyreoiditis ist anfänglich oft schwer abzugrenzen, im langfristigen Verlauf zur Schilddrüsenunterfunktion aber letztlich einfach zu handhaben.
Differenzialdiagnostische Probleme kann die Schilddrüsenhormonresistenz bereiten, bei der sowohl TSH als auch die peripheren Schilddrüsenhormone erhöht sein können. Bei dieser genetisch bedingten Normvariante hilft oft die Familienanamnese weiter, die Betroffenen haben in aller Regel keine Beschwerden. Sehr selten führt ein TSH-produzierender Hypophysentumor zu einer Schilddrüsenüberfunktion, auch hier fällt das erhöhte TSH auf.
Zahlreiche weitere, seltene Formen der Schilddrüsenüberfunktion existieren.
Behandlung und Prognose
Die Notwendigkeit einer sofortigen medikamentösen Behandlung ergibt sich meist durch die ausgeprägte Schilddrüsenüberfunktion (Hyperthyreose). Beschwerden durch die Vergrößerung der Schilddrüse (Struma) oder andere Begleitsymptome (z. B. die Endokrine Orbitopathie) können ebenfalls eine Therapie notwendig machen.
Eine ursächliche Behandlung der Autoimmunerkrankung ist bislang nicht bekannt. Eine endgültige (definitive) Behandlung der Überfunktion ist nur mittels Operation oder Radiojodtherapie möglich.
Medikamentöse Therapie
Am Anfang der Behandlung steht immer die medikamentöse Therapie. Hierbei werden den Betroffenen Thyreostatika, die die Bildung der Schilddrüsenhormone hemmen, solange und so hoch dosiert gegeben, bis eine Normalisierung der Laborwerte fT3 und fT4 („periphere Euthyreose“) erreicht wird. Eine Normalisierung des TSH-Wertes wird nicht angestrebt. Häufig werden schwefelhaltige Thyreostatika (Propylthiouracil, Carbimazol, Thiamazol und andere) eingesetzt, die jedoch eine etwa ein- bis zweiwöchige Wirklatenz aufweisen. Häufigste Nebenwirkungen sind eine mäßige Verringerung der Zahl der weißen Blutkörperchen (Leukozyten), eine mäßige Erhöhung der Leberenzyme (Transaminasenanstieg), sowie verschiedene Hauterscheinungen (Exanthem, Erythem, Juckreiz, Haarausfall). Sehr seltene, aber gefürchtete Nebenwirkungen sind Hepatitis, Agranulozytose und Vaskulitis.[15]
Propranolol (ein nicht-kardioselektiver β-Rezeptorenblocker) wird bei Herzrasen (Tachykardie) ergänzend eingesetzt, mildert aber auch die nicht-kardialen Symptome der Hyperthyreose und hemmt die Umwandlung (Konversion) von T4 zu T3.
Unter der thyreostatischen Therapie mit einer Dauer von 12 bis 18 Monaten tritt in etwa 40 % der Fälle eine Remission ein, so dass sich nach Absetzen des Thyreostatikums keine hyperthyreote Stoffwechsellage mehr einstellt.[15] Anschließend entwickelt sich jedoch nicht selten eine Schilddrüsenunterfunktion (Hypothyreose).[17] Wegen der Schwere der potentiellen Nebenwirkungen der thyreostatischen Therapie soll diese nicht als Langzeittherapie (über 12 bis 18 Monate) eingesetzt werden. Ausnahmen gelten nur für Patienten, die eine definitive Therapie ablehnen oder wegen schwerer Begleiterkrankungen für die definitiven Therapieformen nicht infrage kommen.[15]
Die medikamentöse Behandlung wird vor allem bei Patienten angewendet, die ein niedriges Rezidivrisiko haben: weibliche Patienten mit einem Alter bei Erkrankungsbeginn von über 40 Jahren, einem Volumen der Schilddrüse unter 40 ml und TSH-Rezeptor-Antikörpern unter 10 U/l. Für die übrigen Patienten (Alter bei Krankheitsbeginn unter 40 Jahre oder männliches Geschlecht oder Schilddrüsenvolumen über 40 ml oder TSH-Rezeptor-Antikörper über 10 U/l) wird wegen der schlechten Remissionsrate dagegen eine frühzeitige definitive Therapie empfohlen.[24] Kinder haben eine höhere Rezidivrate (etwa 70 % innerhalb von zwei Jahren). Unklar ist bisher, ob deshalb eine längere Phase der thyreostatischen Behandlung gerechtfertigt ist.[25]
Definitive Therapie
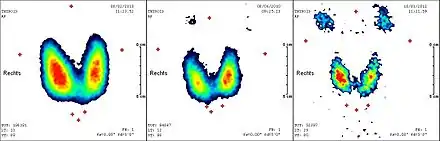
Die Radiojodtherapie stellt eine definitive Therapie des Morbus Basedow dar. Eingesetzt wird radioaktives 131Jod. Es werden Herddosen von 200 bis 300 Gray angestrebt; die Strahlenexposition für den Ganzkörper wird mit 30 bis 40 mSv angegeben, liegt also um etwa vier Zehnerpotenzen niedriger. Da die Therapie erst nach mehreren Wochen wirksam wird, muss mit Thyreostatika vor- und nachbehandelt werden. Wie bei der Operation entwickelt anschließend die überwiegende Mehrzahl der Patienten eine Hypothyreose und bedarf deshalb einer lebenslangen Substitutionsbehandlung mittels oraler Schilddrüsenhormongabe. Als Kontraindikationen gelten Schwangerschaft und Stillzeit, der gleichzeitige Verdacht auf ein Schilddrüsenkarzinom, sowie eine floride endokrine Orbitopathie. Die Erfolgsquote der Radiojodtherapie wird mit 80 bis 90 % angegeben, bei Wiederholungsbehandlung mit 100 %.[15]
Auch die subtotale Schilddrüsenresektion stellt eine definitive Therapie dar. Bei Schwangeren stellt sie die einzige definitive Therapieoption dar, da die Radiojodtherapie wegen der Plazentagängigkeit der Jodisotope kontraindiziert ist.[26] Hierbei wird die Schilddrüse bis auf einen sehr kleinen Rest entfernt. Eine lebenslang behandlungsbedürftige Schilddrüsenunterfunktion wird dabei bewusst herbeigeführt, um die Überfunktion sicher zu beseitigen und das Risiko eines Rückfalls (Rezidiv) zu minimieren. Als (relative) Kontraindikationen gelten erhöhtes Narkoserisiko und eine voroperierte Schilddrüse, insbesondere wenn bereits eine einseitige Rekurrensparese vorliegt. Die Erfolgsquote der Operation liegt über 95 %, die Rezidivquote unter 10 %. Die Komplikationsrate liegt etwas höher als bei Operationen wegen einer Struma mit oder ohne Knoten.[15]
Therapie der endokrinen Orbitopathie
Eine kausale Therapie ist ebenfalls nicht bekannt.[3] Symptomatisch ist bei leichten Formen (Trockenheit der Augen bei Bewegungsstörungen der Lider) lokal der Einsatz von Tränenersatzmitteln oder Salben angezeigt.[27]
In schweren Fällen, bei denen eine vorhandene oder drohende Beeinträchtigung der Sehkraft besteht, werden, solange sich noch keine Fibrose entwickelt hat, zunächst Steroide eingesetzt. Ergänzend kann auch eine Radiotherapie (Orbitaspitzenbestrahlung: Dosis fallabhängig 2–16 Gy) notwendig werden. Auch eine Behandlung der Hyperthyreose ist angezeigt.[27][28]
Liegt bereits eine Fibrose vor, können operative Maßnahmen indiziert sein. Indikationsbezogen werden hier in seltenen Fällen folgende Arten von Operationen durchgeführt:[27]
- Druckminderung in der Orbita – Verhinderung der Strangulation des Nervus opticus und Verminderung der cornealen Exposition,
- Augenmuskeloperationen – Verbesserung der Augenbeweglichkeit, Reduktion von Doppelbildwahrnehmung und Kopfzwanghaltung und
- plastisch-chirurgische Eingriffe an den Augenlidern – Reduktion einer durch inkompletten Lidschlag hervorgerufenen Austrocknung des Auges und Wiederherstellung eines normalen Aussehens.
Literatur
Historische Literatur
- Robert James Graves: New observed affection of the thyroid gland in females.(Clinical lectures.) In: London Medical and Surgical Journal. 7, (Renshaw) 1835; 7, S. 516–517. Nachdruck in: Medical Classics. 5, 1940, S. 33–36.
- K. A. von Basedow: Exophthalmus durch Hypertrophie des Zellgewebes in der Augenhöhle. In: [Casper’s] Wochenschrift für die gesammte Heilkunde. Berlin 1840, 6, S. 197–204, 220–228. Englische Übersetzung in: Ralph Hermon Major: Classic Descriptions of Disease. C. C. Thomas, Springfield 1932.
- K. A. von Basedow: Die Glotzaugen. In: [Casper’s] Wochenschrift für die gesammte Heilkunde. Berlin 1848, S. 769–777.
- Ferdinand Sauerbruch: Vorlesung Über die Basedowsche Krankheit. In: Ferdinand Sauerbruch, Hans Rudolf Berndorff: Das war mein Leben. Kindler & Schiermeyer, Bad Wörishofen 1951; zitiert: Lizenzausgabe für Bertelsmann Lesering, Gütersloh 1956, S. 262–271.
Aktuelle Literatur
- Brakebusch, Heufelder, Zuckschwerdt: „Leben mit Morbus Basedow“ Ein Ratgeber für Betroffene. Ausführliche Erläuterungen zu Symptomen, Therapie, Hormonen und Ursachen, 2002, ISBN 3-88603-799-1.
- Lothar-Andreas Hotze, Petra-Maria Schumm-Draeger: Schilddrüsenkrankheiten. Diagnose und Therapie. Berlin 2003, ISBN 3-88040-002-4.
- Malte H. Stoffregen: Basedowsche Krankheit. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 152.
Weblinks
- Morbus Basedow. Kompetenznetz Immunthyreopathien
- Morbus Basedow. (PDF; 100 kB) schilddruesenguide.de
Einzelnachweise
- Basedow’s syndrome or disease. whonamedit.com; abgerufen am 24. März 2008
- www.whonamedit.com.
- J. Hädecke, U. Schneyer: Endokrinologische Befunde bei der endokrinen Orbitopathie. In: Klin Monatsbl Augenheilkd. 2005; 222, S. 15–18, doi:10.1055/s-2004-813646
- Homepage der Stadt Merseburg. (Memento des Originals vom 2. Februar 2014 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. abgerufen am 24. März 2008
- Barbara I. Tshisuaka: Basedow, Karl Adolf von. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 152.
- Robert James Graves. (Memento vom 13. März 2006 im Internet Archive) www.whonamedit.com; abgerufen am 23. März 2008
- Fritz Spelsberg, Thomas Negele: Schilddrüse. 6. Auflage. S. Hirzel, Stuttgart 2005; 7., unveränderte Auflage ebenda 2008, ISBN 978-3-7776-1584-4, S. 16.
- Wolfgang Wildmeister: Praktische Hinweise zur Schilddrüsen-Diagnostik. Hoechst Aktioengesellschaft 1984, S. 9 f. (Geschichte der Schilddrüsenforschung).
- Ferdinand Sauerbruch: Das war mein Leben. Kindler & Schiermeyer, Bad Wörishofen 1951; Lizenzausgabe für Bertelsmann Lesering, Gütersloh 1956, S. 83 f. und 262–271.
- S. Hertz, A. Roberts: Application of radioactive iodine in therapy of Grave’s disease. In: J div, 21 (624) (1942) d-nb.info abgerufen am 10. März 2008.
- R. Paschke u. a.: Therapie der uni- oder multifokalen Schilddrüsenautonomie. In: Dtsch Arztebl., 2000; abgerufen am 10. März 2008.
- Malte H. Stoffregen: Basedowsche Krankheit. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 152.
- J. Larry Jameson, Anthony P. Weetman (für die deutsche Ausgabe: Jens Zimmermann und George Kahaly): Erkrankungen der Schilddrüse. In: Manfred Dietel, Joachim Dudenhausen, Norbert Suttorp (Hrsg.): Harrisons Innere Medizin. Berlin 2003, ISBN 3-936072-10-8.
- J. R. Siewert, M. Rothmund, V. Schumpelick: Praxis der Viszeralchirurgie: Endokrine Chirurgie. Springer, 2007, ISBN 978-3-540-22717-5, S. 42 books.google.de
- L.-A. Hotze, P.-M. Schumm-Draeger: Schilddrüsenkrankheiten. Diagnose und Therapie. Berlin, 2003, ISBN 3-88040-002-4.
- K. Mann, R. Hörmann: Antithyreoidale und TSH-suppressive Behandlung bei Morbus Basedow? In: Der Internist. Springer Verlag, 1998, (39) 6, S. 600–612, (online)
- K.-H. Niessen: Pädiatrie. Thieme Verlag, 2001, ISBN 3-13-113246-9, S. 242–243. books.google.de
- W. Siegenthaler u. a.: Siegenthalers Differenzialdiagnose. Thieme Verlag, 2005, ISBN 3-13-344819-6, S. 490 ff., books.google.de
- M. Ide u. a.: Polymorphismen des MICA-Mikrosatelliten bei thyreoidaler Autoimmunität. In: Medizinische Klinik. Urban & Vogel, Januar 2007, S. 11–15, ISSN 0723-5003 (online)
- Gerd Herold: Innere Medizin. Köln 2005.
- Ferdinand Sauerbruch: Vorlesung Über die Basedowsche Krankheit. In: Ferdinand Sauerbruch, Hans Rudolf Berndorff: Das war mein Leben. Kindler & Schiermeyer, Bad Wörishofen 1951; zitiert: Lizenzausgabe für Bertelsmann Lesering, Gütersloh 1956, S. 262–271, hier: S. 263.
- A. Heufelder: Morbus Basedow und endokrine Orbitopathie: Konsequenzen aus neuen pathophysiologischen Einsichten. In: K.-M. Derwahl, L.-A. Hotze (Hrsg.): Autoimmunerkrankungen der Schilddrüse. Aktuelles – Bewährtes – Kontroverses. Berlin 2003
- B. Müller, U. Bürgi: Akropachie bei Hyperthyreose. In: Schweiz Med Wochenschr., 129/1999, S. 1560. smw.ch (Memento vom 11. Dezember 2007 im Internet Archive) abgerufen am 14. Februar 2009
- M. J. Reinhardt. Radioiodtherapie gutartiger Schilddrüsenerkrankungen: Morbus Basedow – aktuelle Aspekte. In: Nuklearmediziner. 2005; 28, S. 113–117 doi:10.1055/s-2005-836761
- F. Kaguelidou u. a. Predictors of autoimmune hyperthyroidism relapse in children after discontinuation of antithyroid drug treatment. In: J Clin Endocrinol Metab. 2008 Oct;93(10), S. 3817–3826. Epub 2008 Jul 15. PMID 18628515 doi:10.1210/jc.2008-0842.
- M. J. O’Doherty, P. R. McElhatton, S. H. Thomas: Treating thyrotoxicosis in pregnant or potentially pregnant women. In: BMJ. Band 318, Nummer 7175, Januar 1999, S. 5–6, PMID 9872862, PMC 1114544 (freier Volltext).
- A. J. Augustin: Augenheilkunde. Springer, 2007, ISBN 978-3-540-30454-8, S. 84–85. books.google.de
- J. J. Kanski: Klinische Ophthalmologie Lehrbuch und Atlas. Urban & Fischer, 2008, ISBN 978-3-437-23471-2, S. 174–176. books.google.de