Mirabegron
Mirabegron (INN) ist ein rezeptpflichtiger Arzneistoff aus der Gruppe der β3-Sympathomimetika. Es ist in der EU seit 2012 zur Behandlung der überaktiven Blase zugelassen.[5] Anwendung findet es in der symptomatischen Therapie von imperativem Harndrang, erhöhter Miktionsfrequenz und Dranginkontinenz. Es ist der erste Wirkstoff aus der Arzneistoffgruppe der β3-Sympathomimetika.[6]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
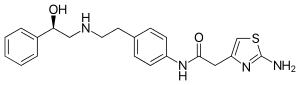 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Mirabegron | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C21H24N4O2S | |||||||||||||||||||||
| Kurzbeschreibung |
weißes Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
G04BD12 | |||||||||||||||||||||
| Wirkstoffklasse |
β3-Sympathomimetika | |||||||||||||||||||||
| Wirkmechanismus |
selektiver β3-Agonist, Entspannung des glatten Blasenmuskels | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 396,51 g·mol−1 | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
schwer löslich in DMF, DMSO und Ethanol,[2] unlöslich in Wasser[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Wirkmechanismus
Mirabegron wirkt als β3-Adrenozeptor-Agonist. Durch eine sympathische Innervation der Harnblase kommt es zu einer Erhöhung der Blasenkapazität und eine Verminderung der Kontraktilität der Blasenmuskulatur.[5] Tierstudien und Versuche an isolierten Blasenmuskelzellen zeigten eine Relaxation der glatten Blasenmuskulatur. In vivo wurde eine Zunahme des Miktionsvolumens festgestellt.[7]
Handel
Mirabegron wird unter den Handelsnamen Betmiga (EU), Myrbetriq (USA) und Betanis (Japan) vertrieben.
Es ist unter anderem in den USA, Europa und Japan zugelassen. In Deutschland wurde der Arzneistoff ab Juni 2014 für ein Jahr verkauft. Jedoch zeigte Mirabegron gegenüber den kostengünstigeren Anticholinergika keinen Zusatznutzen, weswegen es zunächst vom Markt genommen wurde.[8]
Seit dem 15. August 2017 ist es erneut auf dem Markt erhältlich.[9] Es wird jedoch nur als alternatives Therapeutikum bei Nebenwirkungen von Anticholinergika, insbesondere bei Mundtrockenheit, angewendet.[8]
Anwendung und Dosierung
Die Anwendung von Mirabegron erfolgt peroral als Retardtablette in einer Dosis von 25 oder 50 mg einmal täglich.[10]
Nebenwirkungen
Häufige Nebenwirkungen (≥ 1/100 bis < 1/10) sind Harnwegsinfektionen und Tachykardie. Seltener kommt es auch zu Kopfschmerzen, Schwindel, Übelkeit, Obstipation und Durchfall.[8]
Kontraindikation
Mirabegron ist bei schwerer Hypertonie kontraindiziert. Es gab Fälle von hypertensiven Krisen, welche eindeutig auf die Medikation mit Betmiga zurückzuführen sind.[11][12]
Literatur
- E. Mutschler: Arzneimittelwirkungen. 11. Auflage. WVG, Stuttgart 2020, ISBN 978-3-8047-3663-4.
- E. D. Deeks: Mirabegron: A Review in Overactive Bladder Syndrome. In: Drugs. Band 78, 2018, S. 833–844. DOI:10.1007/s40265-018-0924-4
- M. Sanford: Mirabegron: A Review of Its Use in Patients with Overactive Bladder Syndrome. In: Drugs. Band 73, 2013, S. 1213–1225. DOI:10.1007/s40265-013-0086-3
Einzelnachweise
- Datenblatt Mirabegron bei ACS, abgerufen am 15. Mai 2020.
- Datenblatt Mirabegron bei Cayman Chemical, PDF, 27 kB, abgerufen am 15. Mai 2020.
- Datenblatt Mirabegron bei DrugBank, abgerufen am 15. Mai 2020.
- Sicherheitsdatenblatt ClearSynth, abgerufen am 16. Mai 2020.
- Dossier zur Nutzenbewertung, Gemeinsamer Bundesausschuss, PDF, 265 KB, abgerufen am 16. Mai 2020.
- S. Aditya, S. K. Mathur: Mirabegron: A first-in-class beta-3 agonist for overactive bladder. In: J Mahatma Gandhi Inst Med Sci. Band 20, 2015, S. 128–133. doi:10.4103/0971-9903.164227
- T. Hatanaka, M. Ukai, M. Watanabe u. a.: In vitro and in vivo pharmacological profile of the selective β3-adrenoceptor agonist mirabegron in rats. In: Naunyn-Schmiedeberg's Arch Pharmacol. Band 386, 2013, S. 247–253. DOI:10.1007/s00210-012-0821-4
- Wirkstoff AKTUELL Mirabegron, Ausgabe 05/2017, abgerufen am 15. Mai 2020.
- Erneute Marktaufnahme Mirabegron, abgerufen am 14. Mai 2020.
- Betmiga Gebrauchsinformation Astellas, abgerufen am 16. Mai 2020.
- Informationsblatt Mirabegron Astellas, Sep 2015, PDF, 96 kB, abgerufen am 15. Mai 2020.
- Rote-Hand-Brief Astellas, Sep 2015, PDF, 377 KB, abgerufen am 16. Mai 2020.