Miglustat
Miglustat ist ein Arzneistoff, der in der Therapie zweier selten vorkommender erblicher Stoffwechselerkrankungen verwendet wird, dem Morbus Gaucher Typ 1 und der Niemann-Pick-Krankheit Typ C. Beide zählen zu den lysosomalen Speicherkrankheiten.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
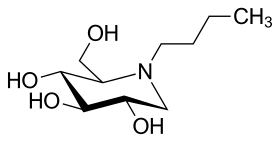 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Miglustat | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C10H21NO4 | |||||||||||||||||||||
| Kurzbeschreibung |
hygroskopischer weißer Feststoff (Hydrochlorid)[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
A16AX06 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 219,28 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt |
170–171 °C[2] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Beschreibung
Chemisch betrachtet ist Miglustat ein Iminozucker und das n-Butyl-Derivat des Naturstoffes Moranolin, einer D-Glucopiperidinose.[4] Als Glucose-Analogon ist es ein reversibler Inhibitor des Enzyms Glucosylceramidsynthase (GCS). GCS katalysiert den ersten Schritt der Biosynthese von Glucosylceramid. Miglustat, reduziert die Aktivität der Glucosylceramidsynthase, wodurch weniger Glucosylceramid in den Zellen produziert werden kann (Substratreduktionstherapie).[5]
Der Arzneistoff ist zur Behandlung der Niemann-Pick-Krankheit Typ C[6] und Morbus Gaucher Typ 1 in der Europäischen Union zugelassen.[7] Bei letzterem allerdings nur bei Patienten, für die die Enzymersatztherapie keine Behandlungsoption ist.[8]
Pharmakokinetik
Im Gegensatz zu den bei der Enzymersatztherapie verabreichten Proteinen zur Behandlung von Morbus Gaucher, ist Miglustat oral bioverfügbar. Das bedeutet, dass der Wirkstoff als Tablette eingenommen werden kann und nicht auf parenteralem Weg, beispielsweise intravenös, verabreicht werden muss. Die orale Bioverfügbarkeit liegt bei 40 bis 60 %. Der Wirkstoff verteilt sich in einer Vielzahl von Organen und Geweben. Therapeutisch wichtig sind dabei das Zentralnervensystem, das Skelett und die Lunge. Miglustat kann die Blut-Hirn-Schranke überwinden und wird über die Nieren ausgeschieden. Bei letzterem erfolgt eine Kombination zwischen glomerulärer Filtration und aktiver Sekretion. Über die Leber werden nur geringe Mengen von Miglustat aus dem Organismus eliminiert.[5]
Nebenwirkungen
Durch die Inhibierung von mehreren Disaccharidasen verursacht Miglustat bei den meisten Patienten Durchfall (in einer Studie 84 %), Gewichtsverlust (64 %), Blähungen (43 %) und Bauchschmerzen (40 %). Weitere häufige Nebenwirkungen betreffen das Nervensystem. Dazu gehören Tremor (29 %), Parästhesien (10 %) und Amnesien (6 %).[9][10] Durch eine Störung der Spermatogenese wird die Fruchtbarkeit bei männlichen Patienten herabgesetzt. Auch wird empfohlen, dass Männer während der Einnahme und bis drei Monate nach dem Absetzen von Miglustat eine zuverlässige Empfängnisverhütung anwenden.[11]
Kosten
Die Behandlungskosten liegen für einen Patienten mit 60 kg Körpergewicht bei etwa 125.000 Euro pro Jahr (Stand: 2003). Im Vergleich zur teureren Enzymersatztherapie mit Imiglucerase sind die Kosten um den Faktor 4,3 niedriger. Die Miglustat-Tabletten mit 100 mg Wirkstoff sind dreimal täglich einzunehmen.[11]
Fertigarzneimittel
Zavesca (D, A, CH)
Weblinks
- Arzneimittel-Kompendium der Schweiz: Miglustat-Präparate
Weiterführende Literatur
- A. Mehta: Gaucher disease: unmet treatment needs. In: Acta paediatrica. Band 97, Nummer 457, April 2008, S. 83–87, doi:10.1111/j.1651-2227.2008.00653.x. PMID 18339195.
- G. M. Pastores, P. Giraldo u. a.: Goal-oriented therapy with miglustat in Gaucher disease. In: Current medical research and opinion. Band 25, Nummer 1, Januar 2009, S. 23–37, doi:10.1185/03007990802576518. PMID 19210136.
- F. M. Platt, M. Jeyakumar: Substrate reduction therapy. In: Acta paediatrica. Band 97, Nummer 457, April 2008, S. 88–93, doi:10.1111/j.1651-2227.2008.00656.x. PMID 18339196.
- P. L. van Giersbergen, J. Dingemanse: Influence of food intake on the pharmacokinetics of miglustat, an inhibitor of glucosylceramide synthase. In: Journal of Clinical Pharmacology. Band 47, Nummer 10, Oktober 2007, S. 1277–1282, doi:10.1177/0091270007305298. PMID 17720777.
- G. M. Pastores: Miglustat: substrate reduction therapy for lysosomal storage disorders associated with primary central nervous system involvement. In: Recent patents on CNS drug discovery. Band 1, Nummer 1, Januar 2006, S. 77–82, PMID 18221193.
- J. Jakóbkiewicz-Banecka, A. Wegrzyn, G. Wegrzyn: Substrate deprivation therapy: a new hope for patients suffering from neuronopathic forms of inherited lysosomal storage diseases. In: Journal of applied genetics. Band 48, Nummer 4, 2007, S. 383–388, doi:10.1007/BF03195237. PMID 17998597.
- R. H. Lachmann: Miglustat: substrate reduction therapy for glycosphingolipid lysosomal storage disorders. In: Drugs of Today. Band 42, Nummer 1, Januar 2006, S. 29–38, doi:10.1358/dot.2006.42.1.937457. PMID 16511609.
- P. L. McCormack, K. L. Goa: Miglustat. In: Drugs. Band 63, Nummer 22, 2003, S. 2427–2434, PMID 14609352.
Einzelnachweise
- Tocris: Miglustat hydrochloride (Seite nicht mehr abrufbar, Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis. (PDF-Datei; 107 kB)
- Merck: N-Butyldeoxynojirimycin, Hydrochloride
- Datenblatt N-Butyldeoxynojirimycin bei Sigma-Aldrich, abgerufen am 10. August 2011 (PDF).
- J. S. Primacombe: Synthesen von Antibiotica-Zuckern. In: Angewandte Chemie. Band 83, Nummer 8, 1971, S. 261–274. doi:10.1002/ange.19710830802
- A. Treiber, O. Morand, M. Clozel: The pharmacokinetics and tissue distribution of the glucosylceramide synthase inhibitor miglustat in the rat. In: Xenobiotica. Band 37, Nummer 3, März 2007, S. 298–314, doi:10.1080/00498250601094543. PMID 17624027.
- M. T. Vanier: Niemann-Pick disease type C. In: Orphanet Journal of Rare Diseases. Band 5, 2010, S. 16, doi:10.1186/1750-1172-5-16. PMID 20525256. PMC 2902432 (freier Volltext).
- Information zu Zavesca auf der Website der europäischen Arzneimittelagentur.
- B. Hoffmann, M. Schwarz u. a.: Gastrointestinal symptoms in 342 patients with Fabry disease: prevalence and response to enzyme replacement therapy. In: Clinical Gastroenterology and Hepatology. Band 5, Nummer 12, Dezember 2007, S. 1447–1453, doi:10.1016/j.cgh.2007.08.012. PMID 17919989.
- G. M. Pastores, N. L. Barnett, E. H. Kolodny: An open-label, noncomparative study of miglustat in type I Gaucher disease: efficacy and tolerability over 24 months of treatment. In: Clinical Therapeutics. Band 27, Nummer 8, August 2005, S. 1215–1227, doi:10.1016/j.clinthera.2005.08.004. PMID 16199246.
- C. E. Hollak, D. Hughes u. a.: Miglustat (Zavesca) in type 1 Gaucher disease: 5-year results of a post-authorisation safety surveillance programme. In: Pharmacoepidemiology and Drug Safety. Band 18, Nummer 9, September 2009, S. 770–777, doi:10.1002/pds.1779. PMID 19507165.
- Miglustat (Zavesca) bei M. Gaucher. (PDF-Datei; 61 kB) In: arznei-telegramm. Band 34, Nummer 5, 2003, S. 4.