Magnesocen
Magnesocen, oder auch Di(cyclopentadienyl)magnesium, Mg(C5H5)2, abgekürzt MgCp2, ist eine metallorganische Verbindung aus der Familie der Metallocene und bildet einen Sandwichkomplex.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
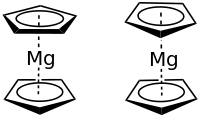 | ||||||||||||||||
| Gestaffelte und ekliptische Konformation | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Magnesocen | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C10H10Mg | |||||||||||||||
| Kurzbeschreibung |
farbloser kristalliner Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 154,491 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit |
zersetzt sich heftig in Wasser, löslich in polaren und unpolaren Lösemitteln.[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Herstellung
Über die erste Herstellung von Magnesocen wurde bereits 1954 unabhängig voneinander von E. O. Fischer und G. Wilkinson berichtet.[5][6] Diese stellten Magnesocen durch Disproportionierung von CpMgBr bzw. durch Reaktion von metallischem Magnesium mit Cyclopentadien bei 500 °C dar. Für erstere Reaktion wurde zunächst Cyclopentadienylmagnesiumbromid durch Umsetzung von Ethylmagnesiumbromid mit Cyclopentadien gewonnen, welches dann bei 220 °C und 10−4 mbar zu MgCp2 und MgBr2 disproportioniert:[7]
- Et2O = Diethylether
Für den Labormaßstab ist auch die Umsetzung von Diorganylmagnesium-Verbindungen mit Cyclopentadien möglich.[1]
Eigenschaften
Magnesocen ist ein weißes bis hellgelbes, bei 50 °C/10−3 mbar sublimierbares Pulver, welches sich mit Wasser heftig zersetzt und sich bei Luftkontakt spontan entzünden kann.[1] Von den Metallocenen der Erdalkalimetallgruppe zeigt nur Magnesocen die klassische Sandwichstruktur. E. Weiß konnte zeigen, dass Magnesocen im Kristall eine gestaffelte Konformation mit einem Mg-C-Abstand von 230 pm hat; dagegen ist nach A. Haland in der Gasphase die Metall-Cp-Bindung aufgeweitet und das Molekül liegt in ekliptischer Konformation vor.[1][7] Wie bei einem Sandwichkomplex mit 12 Valenzelektronen zu erwarten ist, sind die Cp-Ringe parallel angeordnet. Ob die Bindung zwischen Metall und Cp-Ring eher kovalenter oder eher ionischer Art ist, ist noch nicht ganz klar. Die dem Ferrocen analoge Sandwichstruktur lässt nicht zwingend auf eine kovalente Bindung schließen, sie könnte auch durch Van-der-Waals-Wechselwirkungen erklärt werden. Für den eher ionischen Charakter sprechen die elektrische Leitfähigkeit in flüssigem Ammoniak, die heftige Hydrolysereaktion sowie die 13C-NMR Verschiebung von 108 ppm (in Vergleich LiCp = 103,6 ppm; NaCp = 103,4 ppm, FeCp2 = 68,2 ppm).[7][8] Dagegen sprechen 25Mg NMR-Daten eher für eine weitgehend kovalente Bindung.[7]
Wie die schwereren Homologen bildet auch Magnesocen mit sauerstoff-, stickstoff- und phosphorhaltigen Lewis-Basen entsprechende Addukte. So bildet es mit Ammoniak oder Aminen 1:1 oder 1:2 Komplexe, welche sich im Falle von primären oder sekundären Aminen auch isolieren und kristallographisch untersuchen lassen. In diesen Addukten verändert sich die Haptizität eines Cp-Ringes von η5 auf η2.[9] Mit THF bilden sich dagegen ein η5,η1-Komplex.[9]
Spektroskopische Daten
Im IR-Spektrum zeigt Magnesocen Banden bei 2926 cm−1 (arom. C-H-Valenzschwingungen), 1630 cm−1(arom. Ringschwingung) und 770 cm−1 (C-H-Deformationsschwingung). Das 1H-NMR-Spektrum zeigt ein Singulett-Signal bei 6,00 ppm, das 13C-NMR-Spektrum ein Signal bei 107.8 ppm.[1]
Verwendung
Aufgrund der relativ schwachen Magnesium-Cyclopentadienyl Bindung im Magnesocen – verglichen mit anderen Metall-Cyclopentadienylen – wird dieses vielfach zur Cyclopentadienylierung, d. h. für die Übertragung von Cp-Einheiten auf andere Metalle, unter Bildung des stabilen Magnesiumdihalogenids, verwendet.[7]
Magnesocen und dessen Addukte werde als leicht sublimierbare Rohstoffe für Gasabscheidungsverfahren, wie MOCVD, mit denen z. B. grüne oder blaue LEDs hergestellt werden, verwendet.[1]
Einzelnachweise
- Anja Jaenschke: Basenaddukte des Magnesocens: Darstellung und Strukturuntersuchung von Cyclopentadienyl-, Pentamethylcyclopentadienyl- und Indenyl-Metallocenen des Magnesiums. Dissertation, Uni Hamburg, 2006 urn:nbn:de:gbv:18-30786.
- W. A. Barber: Magnesium cyclopentadienide. In: Eugene G. Rochow (Hrsg.): Inorganic Syntheses. Band 6. McGraw-Hill Book Company, Inc., 1960, S. 11–15 (englisch).
- Eintrag zu Bis(cyclopentadienyl)magnesium bei ChemicalBook, abgerufen am 30. Dezember 2011.
- Datenblatt Bis(cyclopentadienyl)magnesium(II), ≥95%, ≥99.99% trace metals basis (excludes ~300ppm Al) bei Sigma-Aldrich, abgerufen am 7. November 2021 (PDF).
- E. O. Fischer, W. Hafner: Cyclopentadienyl-vanadin-tetracarbonyl. In: Zeitschrift für Naturforschung B. 9, 1954, S. 503–504 (online).
- G. Wilkenson, F.A. Cotton, Chem. Ind.(London) 1954, 307–308
- Christoph Elschenbroich: Organometallchemie. 6. Auflage, Teubner Wiesbaden, 2008, ISBN 978-3-8351-0167-8, S. 65 (eingeschränkte Vorschau in der Google-Buchsuche).
- Erwin Riedel: Moderne Anorganische Chemie. de Gruyter, 2007, ISBN 978-3-11-019060-1, S. 623 (eingeschränkte Vorschau in der Google-Buchsuche).
- Zvi Rappoport, Ilan Marek: The Chemistry of Organomagnesium Compounds, Band 2. John Wiley & Sons, 2008, ISBN 978-0-470-05719-3, S. 122–129 (eingeschränkte Vorschau in der Google-Buchsuche).

