Madelung-Indolsynthese
Die Madelung-Indolsynthese, die auch als Madelung-Synthese, Madelung-Reaktion oder Madelung-Cyclisierung bezeichnet wird, ist eine Namensreaktion der organischen Chemie. Benannt wurde sie nach dem deutschen Chemiker Walter Madelung (1879–1963), der die Reaktion 1912 veröffentlichte.[1] Die Reaktion ermöglicht die Synthese von Indolderivaten aus ortho-Alkyl-N-acylanilinen.[2][3][4][5]
Übersichtsreaktion
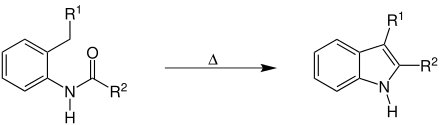
Setzt man ortho-Alkyl-N-acylaniline bei hohen Temperaturen mit einer starken Base (zum Beispiel Kaliumalkoholate) um, so entstehen unter Wasserabspaltung Indolderivate.
Anstelle von Kaliumalkoholaten können auch Basen wie Natriumamid oder Alkyl- und Aryllithium[4] (wie z. B. Butyllithium) verwendet werden. Im ersten Fall ist die benötigte Temperatur schon erheblich niedriger und bei der Reaktion mit Butyllithium kann die Reaktion sogar bei Raumtemperatur durchgeführt werden.
Mechanismus
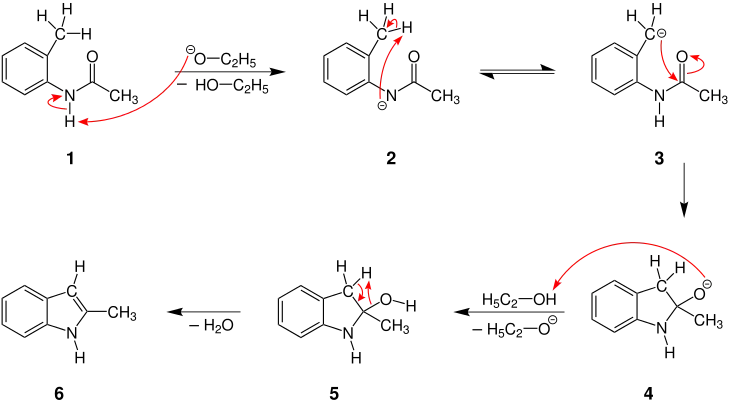
Der Mechanismus der Madelung-Indolsynthese wird hier am Beispiel der Reaktion von N-(2-Methylphenyl)acetamid (1) mit Ethanolat als Base dargestellt:[1]
 Mechanismus der Madelung-Indolsynthese
Mechanismus der Madelung-Indolsynthese
Zunächst deprotoniert die Base (hier Ethanolat) das Stickstoffatom des N-(2-Methylphenyl)acetamids (1). Im so entstandenen Anion 2 findet eine 1,3-Protonenverschiebung statt unter Bildung des Carbanions 3. Dieses greift nun intramolekular das Kohlenstoffatom der Carbonylgruppe an und bildet somit ein heterocyclisches Intermediat 4. Dessen Protonierung liefert den Alkohol 5, der unter Abspaltung von Wasser und der Ausbildung einer C=C-Doppelbindung zum Indol 6 führt, hier 2-Methyl-1H-indol.[1]
Diese Methode ist geeignet um in Position 2 substituierte Indole herzustellen, während unsubstituiertes Indol mit sehr schlechter Ausbeute, bzw. nur in Spuren entsteht.[1] Auf der anderen Seite ergeben sich Schwierigkeiten bei der Synthese von halogensubstituierten Indolen.[1][6]
Einzelnachweise
- Z. Wang: Comprehensive Organic Name Reactions and Reagents, 3 Volume Set. John Wiley & Sons, Hoboken, New Jersey 2009, ISBN 978-0-471-70450-8, S. 1791–1792.
- W. Madelung: Über eine neue Darstellungsweise für substituierte Indole. I. In: Ber. Dtsch. Chem. Ges. Band 45, Nr. 1, 1912, S. 1128–1134, doi:10.1002/cber.191204501160.
- W. J. Houlihan, Y. Uike, V. A. Parrino: Novel cycloaddition products formed by the modified Madelung indole synthesis. In: J. Org. Chem. Band 46, Nr. 22, 1981, S. 4515–4517, doi:10.1021/jo00335a039.
- L. Kürti, B. Czakó: Strategic Applications of Named Reactions in Organic Synthesis. Elsevier Academic Press, Amsterdam 2005, ISBN 978-0-12-429785-2, S. 270–271.
- W. J. Houlihan: The Chemistry of Heterocyclic Compounds. Indoles Part One. John Wiley & Sons, Inc., New York 1972, ISBN 0-471-37500-4, S. 385–396.
- W. J. Houlihan, V. A. Parrino, Y. Uike: Lithiation of N-(2-alkylphenyl)alkanamides and related compounds. A modified Madelung indole synthesis. In: J. Org. Chem. Band 46, Nr. 22, 1981, S. 4511–4515, doi:10.1021/jo00335a038.