Lithiumhexafluorosilicat
Lithiumhexafluorosilicat ist eine chemische Verbindung des Lithiums aus der Gruppe der Hexafluorosilicate.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
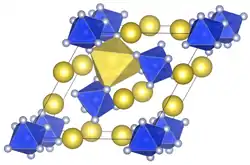 | ||||||||||||||||
| _ Li+ _ Si4+ _ F− | ||||||||||||||||
| Kristallsystem |
trigonal | |||||||||||||||
| Raumgruppe |
P321 (Nr. 150) | |||||||||||||||
| Gitterparameter |
a = 8.219(2) Å, c = 4.5580(9) Å, Z = 3[1] | |||||||||||||||
| Koordinationszahlen |
[6]Si, [6]Li | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Lithiumhexafluorosilicat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | Li2[SiF6] | |||||||||||||||
| Kurzbeschreibung |
weißer geruchloser Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 155,96 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Dichte |
2,8 g·cm−3[3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
löslich in Wasser und Methanol[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Lithiumhexafluorosilicat kann durch Reaktion von Hexafluoridokieselsäure mit Lithiumhydroxid oder Lithiumcarbonat bzw. durch Reaktion von Siliciumtetrafluorid mit Lithiumfluorid gewonnen werden.[4] Sie wurde 1954 erstmals durch B. Cox synthetisiert.[1]
Eigenschaften
Lithiumhexafluorosilicat ist ein weißer geruchloser Feststoff, der löslich in Wasser und Methanol ist.[2] Sie zersetzt sich beim Erhitzen ab 250 °C in Lithiumfluorid und Silicium(IV)-fluorid und besitzt eine trigonale Kristallstruktur mit der Raumgruppe P321 (Raumgruppen-Nr. 150) und drei Formeleinheiten pro Elementarzelle, isotyp zu Natriumhexafluorosilicat.[1]
Verwendung
Lithiumhexafluorosilicat wird als Zwischenprodukt zur Herstellung von Pharmazeutika und anderen chemischen Verbindungen eingesetzt.[2] Es ist auch ein Zwischenprodukt bei der Darstellung von Lithiumchlorid aus lithiumhaltigen Mineralien durch Aufschluss mit Hexafluoridokieselsäure.[5]
Einzelnachweise
- Hinteregger, Ernst; Wurst, Klaus; Niederwieser, Niklas; Heymann, Gunter; Huppertz, Hubert: Pressure-supported crystal growth and single-crystal structure determination of Li2SiF6. In: Zeitschrift für Kristallographie - Crystalline Materials, 2014, Band 229, Heft 2, S. 77–82, doi:10.1515/zkri-2013-1622.
- Datenblatt Lithium hexafluorosilicate bei AlfaAesar, abgerufen am 25. November 2016 (PDF) (JavaScript erforderlich).
- R. Blachnik: Taschenbuch für Chemiker und Physiker Band 3: Elemente, anorganische Verbindungen und Materialien, Minerale. Springer-Verlag, 2013, ISBN 978-3-642-58842-6, S. 542 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu Fluorosilicate. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. November 2016.
- R. J. Meyer: Lithium Ergänzungsband. Springer-Verlag, 2013, ISBN 978-3-662-12268-6, S. 519 (eingeschränkte Vorschau in der Google-Buchsuche).
