Latrunculine
Latrunculine sind Makrolid-Toxine, die von verschiedenen marinen Lebewesen produziert werden. Sie sind Zytoskelett-Inhibitoren, die reversibel die Aktin-Polymerisation zu Mikrofilamenten verhindern. Sie zeichnen sich durch eine für Biomoleküle seltene Thiazolidin-2-on-Struktur aus und wirken toxisch auf eine Vielzahl von Tieren, Pflanzen und Zelllinien.[1][2]

Vorkommen und Geschichte
Entdeckt wurden sie 1983 im Seeschwamm Negombata magnifica, der im Roten Meer und dem Indischen Ozean heimisch ist.[3] Der Schwamm Negombata magnifica aus der Klasse der Hornkieselschwämme wird etwa 70 cm groß, ist rötlich-braun gefärbt und wächst als Kolonie exponiert und in großer Zahl. Die Schwämme fallen dadurch auf, dass sie selten Fress-Schäden zeigen, obwohl sie sich nicht zwischen Korallen und Felsen verbergen. Bei Berührung gibt der Schwamm eine rötliche Flüssigkeit frei, vor der Fische davonschwimmen. Können sie nicht entkommen, wie in einem Aquarium, wirkt das Sekret tödlich. Die vergifteten Fische zeigen innerhalb von Sekunden Symptome wie Hämorrhagie und einen Verlust des Gleichgewichts. Aus diesem Sekret konnten 1983 die Toxine Latrunculin A und B[3], später auch C und M, die Latrunculine G und H unter Zusatz von Formaldehyd isoliert werden. Latrunculin S konnte später aus Fasciospongia rimosa und Latrunculin T aus Negombata magnifica isoliert werden.[4] 1986 gelang die erste Synthese von Latrunculin B[5], 1990 die Synthese von Latrunculin A.[6][7] In den Folgejahren stellte sich heraus, dass Latrunculine ebenfalls in verschiedenen Seeschnecken der Familie der Prachtsternschnecken und anderen Schwämmen, wie Spongia mycofijiensis vorkommen.[7][8][9]
Eigenschaften
Latrunculine sind wachsartige Feststoffe und werden typischerweise in DMSO oder Ethanol gelöst. Beide Latrunculine sind schlecht wasserlöslich und in Lösung ist Latrunculin A stabiler als Latrunculin B. Latrunculin A zerfällt jedoch in Gegenwart von Säuren oder Laugen schneller als Latrunculin B.[2][10][11][12][13]
| Latrunculine | ||||||||||
| Name | Latrunculin A | Latrunculin B | Latrunculin C | Latrunculin D | Latrunculin G | Latrunculin H | Latrunculin M | Latrunculin S | Latrunculin T | |
| Andere Namen | (4R)-[(1R,4Z,8E,10Z,12S,15R,17R)-17-Hydroxy-5,12-dimethyl-3-oxo-2,16-dioxabicyclo[13.3.1]nonadeca-4,8,10-trien-17-yl]thiazolidin-2-on | Latrunculin-C-15-Keton,11-Methylether | N-(Hydroxymethyl)-latrunculin A | N-(Hydroxymethyl)-latrunculin B | ||||||
| Strukturformel |  |
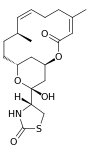 |
 |
 |
 |
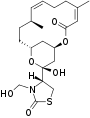 |
 |
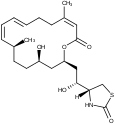 |
 | |
| CAS-Nummer | 76343-93-6 | 76343-94-7 | 76376-32-4 | 98155-17-0[14] | 122876-69-1[15] | 122876-74-8 | 122876-49-7 | 175992-99-1 | 877381-96-9 | |
| PubChem | 445420 | 6436219 | 44589658 | 6442448 | 10093792 | 15939613 | ||||
| Summenformel | C22H31NO5S | C20H29NO5S | C20H31NO5S | C21H31NO5S | C23H33NO6S | C21H31NO6S | C21H33NO5S | C22H33NO5S | C20H27NO5S | |
| Molare Masse | 421,55 g·mol−1 | 395,51 g·mol−1 | 397,53 g·mol−1 | 409,54 g·mol−1 | 451,58 g·mol−1 | 425,54 g·mol−1 | 411,56 g·mol−1 | 423,57 g·mol−1 | 393,50 g·mol−1 | |
| Aggregatzustand | fest | fest | ||||||||
| Kurzbeschreibung | wachsartiger Feststoff[16] | gelber Feststoff[13] | ||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit | löslich in DMSO und Ethanol[16] | löslich in Ethanol[13] | ||||||||
| GHS- Kennzeichnung |
|
|
||||||||
| H- und P-Sätze | keine H-Sätze | keine H-Sätze | ||||||||
| keine P-Sätze | keine P-Sätze | |||||||||
| Wikidata | Q4255014 | Q4255012 | ||||||||
Wirkung
Latrunculin-A und -B verhindern die Bindung von monomerem G-Aktin an das Nukleotid Adenosintriphosphat (ATP). Nur an ATP gebundenes G-Aktin kann zum filamentösen F-Actin polymerisieren und so stören Latriculine den Aufbau des Zytoskeletts.[17][18] Latrunculine wirken sehr spezifisch: Sie wechselwirken im Gegensatz zu vielen Zytoskelett-Inhibitoren nur mit Aktin und lassen Mikrotubuli intakt. Latrunculin A ist wirksamer als Latrunculin B, wobei beide mehr als 100-fach wirksamer als Cytochalasin sind.[19]
Verwendung
Latrunculine haben keine medizinischen Anwendungen, werden jedoch für die Grundlagenforschung produziert. Sie werden für Untersuchungen am Zytoskeletts verwendet, waren mitverantwortlich für die Entdeckung von Cadherin und verändern die elektrische Aktivität von Nervenzellen.[9] Latrunculin-Derivate haben Potential als neuartige Chemotherapeutika.[20][21]
Siehe auch
Die Phallotoxine des Grünen und des Weißen Knollenblätterpilzes binden irreversibel an F-Actin und behindern die Depolymerisation der Mikrofilamente. Insbesondere auf Mikrotubuli wirkt das Colchicin der Herbstzeitlose, das Chemotherapeutikum Vinblastin, und Paclitaxel, einer der Giftstoffe der Pazifischen Eibe.
Einzelnachweise
- I. Spector, N. R. Shochet, D. Blasberger, Y. Kashman: Latrunculins–novel marine macrolides that disrupt microfilament organization and affect cell growth: I. Comparison with cytochalasin D. In: Cell motility and the cytoskeleton. Band 13, Nummer 3, 1989, S. 127–144, doi:10.1002/cm.970130302, PMID 2776221.
- M. Coué, S. L. Brenner, I. Spector, E. D. Korn: Inhibition of actin polymerization by latrunculin A. In: FEBS Letters. Band 213, Nummer 2, März 1987, S. 316–318, PMID 3556584.
- I. Spector, N. R. Shochet, Y. Kashman, A. Groweiss: Latrunculins: novel marine toxins that disrupt microfilament organization in cultured cells. In: Science. Band 219, Nummer 4584, Februar 1983, S. 493–495, PMID 6681676.
- Eintrag zu Latrunculine. In: Römpp Online. Georg Thieme Verlag, abgerufen am 31. August 2015.
- R. Zibuck, N. J. Liverton, A. B. Smith: Total synthesis of (+)-latrunculin B. In: Journal of the American Chemical Society. Band 108, Nummer 9, April 1986, S. 2451–2453, doi:10.1021/ja00269a056, PMID 22175603.
- A. B. Smith, I. Noda, S. W. Remiszewski, N. J. Liverton, R. Zibuck: Total synthesis of (+)-latrunculin A. In: The Journal of Organic Chemistry. Band 55, Nummer 13, 1990 S. 3977–3979, doi:10.1021/jo00300a006.
- J. D. White and M. Kawasaki: Total synthesis of (+)-latrunculin A. In: Journal of the American Chemical Society. Band 112, Nummer 12, 1990S. 4991–4993, doi:10.1021/ja00168a071.
- Y. Kakou, P. Crews, G. J. Bakus: Dendrolasin and Latrunculin A from the Fijian Sponge Spongia mycofijiensis and an Associated Nudibranch Chromodoris lochi. In: Journal of Natural Products. Band 50, Nummer 3, 1987S. 482–484, doi:10.1021/np50051a023.
- W. E. Houssen, M. Jaspars, K. N. Wease, R. H. Scott: Acute actions of marine toxin latrunculin A on the electrophysiological properties of cultured dorsal root ganglion neurones. In: Comparative Biochemistry and Physiology – Part C Toxicology & Pharmacology. Band 142, Nummer 1–2, 2006 Jan-Feb, S. 19–29, doi:10.1016/j.cbpc.2005.09.006, PMID 16280258.
- Datenblatt Latrunculine bei Thermofisher, abgerufen am 23. August 2015.
- Datenblatt Latrunculine bei Tocris, abgerufen am 23. August 2015.
- Datenblatt Latrunculin A bei Sigma-Aldrich, abgerufen am 23. August 2015 (PDF).
- Datenblatt Latrunculin B from Latruncula magnifica, ≥80% (HPLC), solid bei Sigma-Aldrich, abgerufen am 23. August 2015 (PDF).
- Ian W. Southon, John Buckingham: Dictionary of Alkaloids, Second Edition with CD-ROM. CRC Press, 1989, ISBN 978-0-412-24910-5, S. 631 (eingeschränkte Vorschau in der Google-Buchsuche).
- John W. Blunt, Murray H. G. Munro: Dictionary of Marine Natural Products with CD-ROM. CRC Press, 2007, ISBN 978-0-8493-8217-8, S. 1271 (eingeschränkte Vorschau in der Google-Buchsuche).
- Datenblatt Latrunculin A, from sea sponge, ≥85% (HPLC), waxy solid bei Sigma-Aldrich, abgerufen am 28. August 2015 (PDF).
- E. G. Yarmola, T. Somasundaram, T. A. Boring, I. Spector, M. R. Bubb: Actin-latrunculin A structure and function. Differential modulation of actin-binding protein function by latrunculin A. In: Journal of Biological Chemistry. Band 275, Nummer 36, September 2000, S. 28120–28127, doi:10.1074/jbc.M004253200, PMID 10859320.
- J. J. Bounhiol, M. Delsol: [Influence of the environment on the metamorphosis of amphibians (temperature, light, molecular concentration of water)]. In: Problèmes actuels d'endocrinologie et de nutrition. Band 19, 1975, S. 265–278, PMID 1085932.
- T. Wakatsuki, B. Schwab, N. C. Thompson, E. L. Elson: Effects of cytochalasin D and latrunculin B on mechanical properties of cells. In: Journal of cell science. Band 114, Pt 5 März 2001, S. 1025–1036, PMID 11181185.
- M. A. Khanfar, D. T. Youssef, K. A. El Sayed: Semisynthetic latrunculin derivatives as inhibitors of metastatic breast cancer: biological evaluations, preliminary structure-activity relationship and molecular modeling studies. In: ChemMedChem. Band 5, Nummer 2, Februar 2010, S. 274–285, doi:10.1002/cmdc.200900430, PMID 20043312, PMC 3529144 (freier Volltext).
- H. Konishi, S. Kikuchi, T. Ochiai, H. Ikoma, T. Kubota, D. Ichikawa, H. Fujiwara, K. Okamoto, C. Sakakura, T. Sonoyama, Y. Kokuba, H. Sasaki, T. Matsui, E. Otsuji: Latrunculin a has a strong anticancer effect in a peritoneal dissemination model of human gastric cancer in mice. In: Anticancer Research. Band 29, Nummer 6, Juni 2009, S. 2091–2097, PMID 19528469.