Larock-Indolsynthese
Die Larock-Indolsynthese ist eine Namensreaktion der Organischen Chemie, die 1991 von dem amerikanischen Professor für Organische Chemie Richard C. Larock entdeckt wurde. Die Reaktion dient der Synthese von Indolen durch palladiumkatalysierte Anellierung aus o-Iodanilinen und disubstituierten Alkinen.[1]
Übersichtsreaktion
Bei der Larock-Indolsynthese handelt es sich um eine Eintopfreaktion, bei der 2,3-disubstituierte Indole entstehen.[2] Hierzu verwendete Larock o-Iodanilin und seine Derivate mit Alkyl-, Aryl- bzw. Wasserstoffrest R1 sowie disubstituierte Alkine, dessen Reste R2 und R3 Alkyl-, Aryl-, Alkenyl-, Alkoxy- oder Silylgruppen sein können.[3] Die besten Ergebnisse lassen sich durch den Einsatz von Carbonaten oder Acetaten als Base und durch die Zugabe von Lithiumchlorid erzielen.[4]

Diese Indolsynthese verläuft regioselektiv und wird durch den sterischen Anspruch der Alkinreste beeinflusst. Das hat zur Folge, dass sich der sterisch anspruchsvollere Rest nach der Reaktion immer an der ortho-Position des entstandenen Indols befindet.
Mechanismus
Der Mechanismus[5][6] beginnt mit der Reduktion des Palladium(II)-Katalysators (L2(OAc)2Pd) zum Palladium(0)-Komplex und ähnelt dem Mechanismus der Heck-Reaktion. Als Ligand L kann beispielsweise das Triphenylphosphin verwendet werden. Nach der Stabilisierung des Palladium(0)-Komplexes mit Hilfe vom Chlorid-Ion kann der Katalysezyklus mit der oxidativen Addition des o-Iodanilins 1 an dem stabilisierten Palladium(0)-Komplex beginnen. Es kommt zu einer regioselektiven syn-Insertion des Palladiums in die Kohlenstoff-Iod-Bindung, sodass ein neuer Palladium-Komplex entsteht. Dieser reagiert als nächstes mit dem Alkin 2, was zur Bildung des π-Alkin-σ-Organopalladiumkomplexes 3 zwischen dem Alkin und der Palladiumspezies führt. Dabei ist 3 so ausgerichtet, dass der sterisch anspruchsvollere Rest des Alkins nicht zum direkten Nachbarn des organischen Restes wird. Gleichzeitig zum Additionsschritt tritt ein Ligand aus der Komplexverbindung aus. Es schließt sich eine Carbopalladierung der C≡C-Dreifachbindung an und der ausgetretene Ligand wird wieder in den Komplex aufgenommen. Es entsteht das Carbopalladierungsintermediat 4. Im nächsten Schritt greift das Stickstoffatom der Aminogruppe das Palladiumatom nukleophil an, während sich gleichzeitig Iodwasserstoff durch die Zugabe der Base – wie zum Beispiel Kaliumcarbonat (K2CO3) – aus dem Komplex 4 abgespalten wird. Dabei bildet sich ein Sechsring. Zum Abschluss des Katalysezyklus erfolgt eine reduktive Eliminierung, was zur Bildung des Indols 5 und einer Wiederherstellung des Palladium(0)-Komplexes führt.
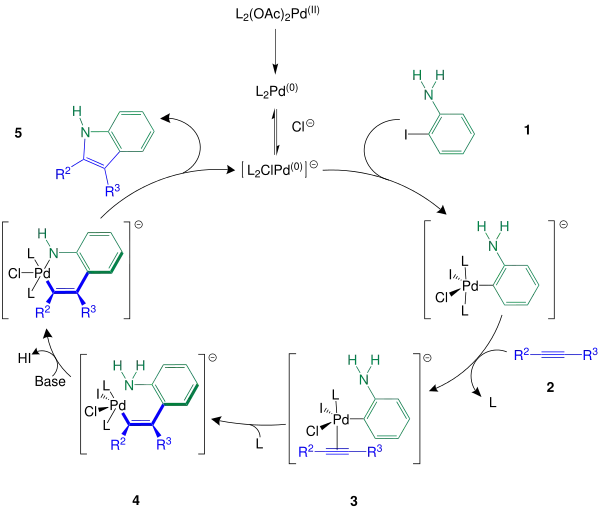
Die Organylreste R2 und R3 entsprechen den erwähnten Resten in dem Abschnitt Übersichtsreaktion.
Einzelnachweise
- R. C. Larock, E. K. Yum: Synthesis of Indoles via Palladium-Catalyzed Heteroannulation of Internal Alkynes. In: J. Am. Chem. Soc. Band 113, 1991, S. 6689–6690, doi:10.1021/ja00017a059.
- G. W. Gribble: Recent developments in indole ring synthesis — methodology and applications. In: J. Chem. Soc., Perkin Trans. 1. Band 1, 2000, S. 1045–1075, doi:10.1039/a909834h.
- L. Kürti, B. Czakó: Strategic Applications of Named Reactions in Organic Synthesis – Background and Detailed Mechanisms. Elsevier Inc., 2005, ISBN 978-0-12-369483-6, S. 260–261.
- R. C. Larock, E. K. Yum: Synthesis of Indoles via Palladium-Catalyzed Heteroannulation of Internal Alkynes. In: J. Am. Chem. Soc. Band 113, 1991, S. 6689–6690, doi:10.1021/ja00017a059.
- R. C. Larock, E. K. Yum, M. D. Refvik: Synthesis of 2,3-Disubstituted Indoles via Palladium-Catalyzed Annulation of Internal Alkynes. In: J. Org. Chem. Band 63, 1998, S. 7652–7662, doi:10.1021/jo9803277.
- L. Kürti, B. Czakó: Strategic Applications of Named Reactions in Organic Synthesis – Background and Detailed Mechanisms. Elsevier Inc., 2005, ISBN 978-0-12-369483-6, S. 260–261.