Lanosterin-Synthase
Die Lanosterin-Synthase ist ein Enzym aus der Gruppe der Oxidosqualen-Cyclasen, das in Eukaryoten die Cyclisierung von Squalenepoxid zu Lanosterin katalysiert. Diese Reaktion ist Teil der Cholesterinbiosynthese in Tieren und in Pflanzen, wobei diese Squalenepoxid hauptsächlich zu Cycloartenol umsetzen. Die Lanosterin-Synthase ist in der Membran des endoplasmatischen Retikulum lokalisiert.[2][3][4]
| Lanosterin-Synthase | ||
|---|---|---|
 | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 732 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Monomer, Membranprotein (ER) | |
| Bezeichner | ||
| Gen-Namen | LSS OSC | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 5.4.99.7, Isomerase | |
| Reaktionsart | Zyklisierung | |
| Substrat | Squalenepoxid | |
| Produkte | Lanosterin | |
| Vorkommen | ||
| Übergeordnetes Taxon | Eukaryoten[1] | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 4047 | 16987 |
| Ensembl | ENSG00000160285 | ENSMUSG00000033105 |
| UniProt | P48449 | Q8BLN5 |
| Refseq (mRNA) | NM_001001438 | NM_146006 |
| Refseq (Protein) | NP_001001438 | NP_666118 |
| Genlocus | Chr 21: 46.19 – 46.23 Mb | Chr 10: 76.53 – 76.56 Mb |
| PubMed-Suche | 4047 | 16987 |
Die Cycloartenol-Synthase in Pflanzen und die Hopensynthase in manchen Bakterien sind Homologe der Lanosterin-Synthase, die mit ihr evolutionsbiologisch verwandt sind.[2]
Die Expression der Lanosterin-Synthase wird durch die Konzentration von HDAC3 im Nukleus reguliert.[5]
Katalysierte Reaktion
-Squalen-2%252C3-epoxid.svg.png.webp) ⇒
⇒ 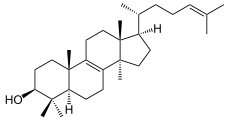
(S)-Squalen-2,3-epoxid wird zu Lanosterin cyclisiert.
Weblinks
Wikibooks: Biochemie und Pathobiochemie: Cholesterinbiosynthese – Lern- und Lehrmaterialien
- Jassal / reactome: Squalene 2,3-epoxide cyclizes, forming lanosterol
Einzelnachweise
- Homologe bei OMA (Memento vom 11. April 2016 im Internet Archive)
- PROSITE documentation PDOC00825. Terpene synthases. Swiss Institute of Bioinformatics (SIB), abgerufen am 12. August 2011 (englisch).
- Ruf A, Müller F, D'Arcy B, et al.: The monotopic membrane protein human oxidosqualene cyclase is active as monomer. In: Biochem. Biophys. Res. Commun.. 315, Nr. 2, März 2004, S. 247–54. doi:10.1016/j.bbrc.2004.01.052. PMID 14766201.
- Kolesnikova MD, Xiong Q, Lodeiro S, Hua L, Matsuda SP: Lanosterol biosynthesis in plants. In: Arch. Biochem. Biophys.. 447, Nr. 1, März 2006, S. 87–95. doi:10.1016/j.abb.2005.12.010. PMID 16445886.
- Villagra A, Ulloa N, Zhang X, Yuan Z, Sotomayor E, Seto E: Histone deacetylase 3 down-regulates cholesterol synthesis through repression of lanosterol synthase gene expression. In: J. Biol. Chem.. 282, Nr. 49, Dezember 2007, S. 35457–70. doi:10.1074/jbc.M701719200. PMID 17925399.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. The authors of the article are listed here. Additional terms may apply for the media files, click on images to show image meta data.