Langzeitpotenzierung
Die Langzeitpotenzierung (englisch long-term potentiation, LTP) ist ein an Synapsen von Nervenzellen beobachtetes Phänomen. Sie stellt eine Form der synaptischen Plastizität dar. Unter LTP versteht man eine langandauernde (long-term) Verstärkung (potentiation) der synaptischen Übertragung.
LTP und Lernen
Aus Sicht der Neurophysiologie und Neuropsychologie besteht ein Zusammenhang zwischen dem Erlernen von Fähigkeiten und den hierbei ablaufenden Veränderungen eines neuronalen Netzes, der in Form veränderter synaptischer Verknüpfungen in dessen Netzwerk ein morphologisch fassbares Korrelat hat. So werden neue Verbindungen angelegt und frühere Verschaltungen aufgehoben, wenn durch wiederholte Aktivitätsmuster oder Training Fähigkeiten gelernt oder verbessert werden, etwa neue Wörter oder Wortbedeutungen gelernt werden.
Beim Sprechen entsteht beispielsweise im Assoziationskortex die Idee, ein Wort auszusprechen, und es wird ein spezielles Netzwerk aktiviert, das ein charakteristisches Muster von Aktionspotentialen entsendet. Erst nach weiteren Verschaltungen erreichen diese Signale schließlich über Motoneuronen auch Muskelzellen verschiedener Muskeln unterschiedlicher Muskelgruppen. Deren nach Kraftentfaltung und zeitlicher Abfolge koordinierte und kontrollierte Kontraktion erfordert ein hoch differenziertes, zeitlich abgestimmtes Muster der hierfür notwendigen neuronalen Signalfolgen. Dies muss erlernt werden – das richtige Aussprechen eines Wortes. Die bei den nötigen neuralen Umbauprozessen stattfindenden Veränderungen von Synapsen sind Ausdruck ihrer Formbarkeit, synaptische Plastizität genannt. Auf Ebene der Neuronen ist Lernen die aktivitätsabhängige Veränderung von Verschaltungsmustern und Funktionsabläufen. Diese aktivitätsabhängigen neuronalen Veränderungen werden auf verschiedene Weise realisiert, wobei die Mechanismen unterschiedlich stark in verschiedenen Neuronen der Großhirnrindenareale, des limbischen Systems, des Kleinhirns und des Hirnstamms ausgebildet sein können. Dazu gehören z. B. die
- präsynaptische Verstärkung (presynaptic enhancement = facilitation),
- posttetanische Potenzierung,
- synaptische Depression
- sowie die Langzeit-Potenzierung (LTP).
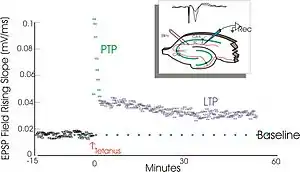
Unter LTP versteht man eine langandauernde Verstärkung der synaptischen Übertragung. Die am besten untersuchte Form der LTP findet an den Synapsen der Pyramidenzellen in der CA1-Region des Hippocampus mit den Schaffer-Kollateralen statt. Der Hippocampus ist beim Menschen für das Anlegen episodischer Gedächtnisinhalte notwendig. Von Mäusen und Ratten ist bekannt, dass der Hippocampus notwendig für räumliches Lernen ist.
Lange Zeit war der direkte Zusammenhang zwischen LTP an den CA1-Synapsen und Lernen noch hypothetisch, doch 2006 wurde dann experimentell der Nachweis erbracht, dass erstens räumliches Lernen bei Ratten LTP erzeugt[2] und zweitens die Unterbindung der Aufrechterhaltung der LTP die Löschung bereits angelegter räumlicher Gedächtnisinhalte zur Folge hat.[3]
LTP in der Entwicklung des Nervensystems
Während der Embryonalentwicklung werden wesentlich mehr neuronale Verschaltungen angelegt, als letztendlich bis zum erwachsenen Menschen überleben werden. Ungefähr ein Drittel aller Neuronen geht während der Entwicklung zu Grunde. Diese Redundanz ist sinnvoll, da zwischen den Neuronen eine Art Wettkampf entsteht, den nur die Nervenzellen überleben, die Verbindungen zu den richtigen Zielen im Gehirn aufbauen.
Zum Beispiel müssen Axone vom primären motorischen Kortex zu Motoneuronen im Rückenmark projizieren.
Fehlgeleitete Neurone sterben ab. Dies geschieht durch fehlende, spezielle Neurotrophine. Weiterhin überleben von den richtig geleiteten Neuronen nur diejenigen, die die stabilsten synaptischen Verbindungen besitzen. Stabile Verbindungen werden dabei gestärkt, dies geschieht durch LTP, während schwache Verbindungen entkoppelt werden, dies geschieht durch Langzeit-Depression (LTD)
- siehe auch: synaptische Plastizität
Zellulärer Mechanismus der NMDA-abhängigen Langzeitpotenzierung
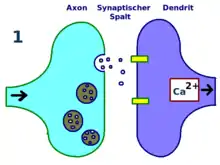
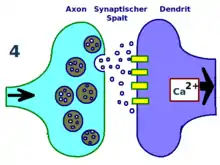
In vielen Bereichen des Gehirns, u. a. in der Großhirnrinde, der Amygdala, dem Kleinhirn (Cerebellum) und im Hippocampus kommen glutamaterge Synapsen vor, die einige besondere Merkmale aufweisen. Wichtigstes Merkmal ist das Vorhandensein von AMPA-Rezeptoren (Unterart von Glutamat-Rezeptoren) sowie N-Methyl-D-Aspartat-Rezeptoren (NMDA-Rezeptor). Letzterer hebt sich von den anderen ionotropen Glutamat-Rezeptoren dadurch ab, dass er zum einen eine sehr große Durchlässigkeit für Calcium-Ionen aufweist, zum anderen bei hyperpolarisierter Membran von außen durch ein Magnesium-Ion verschlossen ist. Neben der NMDA-abhängigen LTP gibt es auch NMDA-unabhängige Formen der LTP.[4][5] Bei der NMDA-abhängigen LTP kommt es zu folgenden Ereignissen an der Synapse:
- Erregung der postsynaptischen Membran durch Glutamat führt zu deren Depolarisation durch die AMPA-Rezeptoren, es entsteht ein Exzitatorisches Postsynaptisches Potential (EPSP).
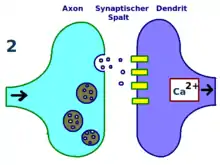
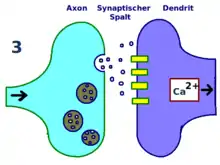
- Nur hochfrequente wiederholte Depolarisation (25–200 Hz) oder gleichzeitige Depolarisation durch mehrere konvergierende, koinzidierende Synapsen führt zur Ladungsabstoßung des Mg-Ions auf dem NMDA-Rezeptor und zu dessen Öffnung. Dies führt zu einem Calcium-Einstrom in die Postsynapse und erhöhter intrazellulärer Ca-Konzentration.
- Calcium aktiviert die Proteinkinase C sowie Ca/Calmodulin-abhängige Kinasen (ohne CaMKII keine LTP).
- Dies führt zu verstärktem Einbau von AMPA- und Kainat-Rezeptoren (beide Glutamatrezeptoren),
- bestehende AMPA-Rezeptoren werden durch die CaMKII phosphoryliert und so deren Durchlässigkeit für Ionen erhöht. Auf diesen Wegen wird die postsynaptische Membran für Glutamat sensitiviert.
- Weiterhin kommt es zu einem physikalischen Wachstum von dendritischen Dornenfortsätzen (Spines) durch Modifikation des Aktin-Cytoskeletts. Solche Veränderungen werden als Grundlage für die „Spätphase“ der LTP angesehen, welche Stunden, Tage bis Wochen anhält. Die Stabilisierung der Vergrößerung eines dendritischen Dornenfortsatzes korreliert mit einer Größenzunahme der postsynaptischen Dichte sowie des axonalen Boutons. Auf molekularer Ebene kommt es zu einer Zunahme der Gerüst-Proteine PSD-95 und Homer1c.[6]
- Seit langem wird diskutiert, ob auch präsynaptische Veränderungen zur LTP beitragen. Diese Veränderungen müssten über einen retrograden Botenstoff ausgelöst werden, der von postsynaptischen Zellen aus auf die präsynaptischen Terminale zurückwirkt. Hier werden insbesondere fünf Klassen von Botenstoffen, von denen retrograde Effekte bekannt sind, untersucht: Lipide, Gase, Peptide, herkömmliche Neurotransmitter und Wachstumsfaktoren.[7]
Folgen für Lerntheorie
Durch LTP können sich selbst verstärkende Kreisläufe (feed-forward-loops) entstehen. Aus lerntheoretischer Sicht sind folgende Punkte interessant:
- NMDA-Rezeptoren sind Koinzidenz-Rezeptoren, das bedeutet, LTP entsteht verstärkt bei synchronisiertem Feuern mehrerer Neurone. Zum Beispiel im Schlaf beobachtet man eine starke Synchronisation von Nervenzellverbänden. Der Papez-Kreis ist eine Verkettung von Gehirnregionen, die an der Einspeicherung von Informationen beteiligt sein soll.
- NMDA-Neurone werden durch das aufsteigende retikuläre Aktivierungssystem (ARAS) modifiziert. Die Transmitter Noradrenalin (aus dem Locus caeruleus), Serotonin (aus den Raphe-Kernen), Acetylcholin (aus dem Nucleus basalis von Theodor Meynert) und Dopamin (aus der Substantia nigra) vermitteln über die Stimulation ihrer Rezeptoren das Verschließen von Kalium-Kanälen und bewirken eine Depolarisation. Depolarisierte Zellen reagieren empfindlicher auf Glutamat-Signale. Aufmerksamkeit spielt somit eine große Rolle bei Lernprozessen.
- Eine schwache Aktivierung der NMDA-Synapsen führt nur zu einem leichten Anstieg intrazellulärer Ca-Konzentration. Dies bewirkt genau das Gegenteil der LTP, nämlich die Langzeit-Depression (LTD).[8]
Geschichte
Der Spanier Santiago Ramon y Cajal kam bereits 1894 auf die Idee, dass Gedächtnis durch die Stärkung der Verbindung zwischen existierenden Neuronen gebildet werde, wodurch es zur Verbesserung ihrer Übertragungseffektivität käme.
Um 1900 glaubte man, dass Gedächtnis nicht das Produkt des Wachstums neuer Nervenzellen sei und dass die Anzahl der Neurone im Gehirn eines Erwachsenen nicht signifikant mit dem Alter ansteige.
Donald O. Hebb (1949) griff diese Ideen auf, ging aber noch einen Schritt weiter: Zellen würden auch neue Verbindungen bilden, um die Effektivität ihrer Übertragung zu verbessern (Hebbsche Regel): Wenn ein Axon der Zelle A die Zelle B errege und wiederholt sowie dauerhaft zur Erzeugung von Aktionspotentialen in Zelle B beitrage, so resultiere dies in Wachstumsprozessen oder Stoffwechseländerungen in einer oder in beiden Zellen, die bewirkten, dass die Effizienz von Zelle A in Bezug auf die Erzeugung eines Aktionspotentials in Zelle B größer werde. (Umgangssprachlicher: What fires together, wires together.)
Die genannten Theorien konnten zu ihrer Zeit noch nicht nachgewiesen werden, da die entsprechenden neurophysiologischen Methoden erst in der zweiten Hälfte des 20. Jahrhunderts zur Verfügung standen.
Die LTP wurde 1966 von Terje Lømo entdeckt und ist heute noch ein wichtiger Forschungsgegenstand (z. B. Entwicklung von Medikamenten, die die biologischen Mechanismen der LTP ausnutzen, um Auswirkungen von Krankheiten wie Morbus Alzheimer oder Morbus Parkinson entgegenzuwirken).
Terje Lømo führte eine Reihe neurophysiologischer Experimente mit betäubten Kaninchen durch, um die Rolle des Hippocampus in Bezug auf das Kurzzeitgedächtnis (KZG) zu untersuchen. Dabei stellt er fest, dass ein einzelner Impuls elektrischer Stimulation des Tractus perforans ein exzitatorisches postsynaptisches Potential (EPSP) im Gyrus dentatus hervorrief. Unerwartet war für Lømo jedoch die Beobachtung, dass eine kurze hochfrequente Serie von Erregungsimpulsen eine lang-andauernde Vergrößerung des EPSPs auslöste. Diese Veränderung nannte man dann LTP. Zusammen mit seinem Mitarbeiter Timothy Bliss publizierte Lømo 1973 die ersten Eigenschaften der LTP im Hippocampus von Kaninchen.[9]
Einzelnachweise
- Michael A. Paradiso, Mark F. Bear, Barry W. Connors: Neuroscience: Exploring the Brain. Lippincott Williams & Wilkins, Hagerstwon, MD (USA) 2007, ISBN 978-0-7817-6003-4, S. 718.
- J. Whitlock, A. Heynen, M. Shuler, M. Bear: Learning induces long-term potentiation in the hippocampus. In: Science. 313(5790), 2006, S. 1093–1097. PMID 16931756.
- E. Pastalkova, P. Serrano, D. Pinkhasova, E. Wallace, A. Fenton, T. Sacktor: Storage of spatial information by the maintenance mechanism of LTP. In: Science. 313(5790), 2006, S. 1141–1144. PMID 16931766.
- L. M. Grover: Evidence for postsynaptic induction and expression of NMDA receptor independent LTP. In: Journal of neurophysiology. Band 79, Nummer 3, März 1998, S. 1167–1182. PMID 9497399 (freier Volltext).
- S. Moosmang, N. Haider, N. Klugbauer, H. Adelsberger, N. Langwieser, J. Müller, M. Stiess, E. Marais, V. Schulla, L. Lacinova, S. Goebbels, K. A. Nave, D. R. Storm, F. Hofmann, T. Kleppisch: Role of hippocampal Cav1.2 Ca2+ channels in NMDA receptor-independent synaptic plasticity and spatial memory. In: The Journal of neuroscience: the official journal of the Society for Neuroscience. Band 25, Nummer 43, Oktober 2005, S. 9883–9892, doi:10.1523/JNEUROSCI.1531-05.2005. PMID 16251435 (freier Volltext).
- D. Meyer, T. Bonhoeffer, V. Scheuss: Balance and Stability of Synaptic Structures during Synaptic Plasticity. In: Neuron. Band 82, Nr. 2, 2014, S. 430–443, doi:10.1016/j.neuron.2014.02.031, PMID 24742464.
- W. G. Regehr, M. R. Carey, A. R. Best: Activity-dependent regulation of synapses by retrograde messengers. In: Neuron. 63(2), 2009, S. 154–170, Review Article, Free Full Text Online. PMID 19640475
- Bruce Alberts, Alexander Johnson, Julian Lewis, David Morgan, Martin Raff, Keith Roberts, Peter Walter: Molekularbiologie der Zelle, 6. Auflage, Wiley-VCH Verlag, Weinheim 2017, ISBN 978-3-527-69845-5, S. 718, Vorschau Google Books.
- T. V. Bliss, T. Lomo: Long-lasting potentiation of synaptic transmission in the dentate area of the anaesthetized rabbit following stimulation of the perforant path. In: J Physiol. 232(2), 1973, S. 331–356, Free Full Text Online. PMID 4727084
Literatur
- Eric R. Kandel u. a. (Hrsg.): Neurowissenschaften – Eine Einführung. Spektrum Akademischer Verlag, 1996, ISBN 3-86025-391-3.
- Dale Purves: Neuroscience. 3. Auflage. Sinauer Associates, 2004, ISBN 0-87893-725-0.
- H. T. Blair, G. E. Schafe, E. P. Bauer, S. M. Rodrigues, J. E. LeDoux: Synaptic plasticity in the lateral amygdala: a cellular hypothesis of fear conditioning. In: Learn Mem. 8, 2001, S. 229–242 (Volltext)