Kynurenin
Kynurenin (griech. kýon Hund und ouron Urin) ist eine aromatische nicht-proteinogene Aminosäure.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
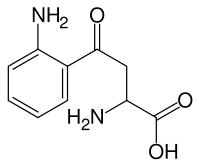 | ||||||||||||||||
| Strukturformel ohne Darstellung der Stereochemie | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Kynurenin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C10H12N2O3 | |||||||||||||||
| Kurzbeschreibung |
farblose Blättchen[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 208,22 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
wenig löslich in Wasser, bildet mit Säuren wasserlösliche Salze[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Isomere
Es existieren zwei Stereoisomere des Kynurenins: (S)-Kynurenin [Synonym: L-Kynurenin] und (R)-Kynurenin [Synonym: D-Kynurenin]. Lediglich die (S)- bzw. L-Form zeigt biologische Aktivität.[3]
| Isomere von Kynurenin | ||
| Name | (S)-Kynurenin | (R)-Kynurenin |
| Andere Namen | L-Kynurenin | D-Kynurenin |
| Strukturformel | -Kynurenine_Structural_Formula.svg.png.webp) | -Kynurenine_Structural_Formula.svg.png.webp) |
| CAS-Nummer | 2922-83-0 | 13441-51-5 |
| 343-65-7 (unspez.) | ||
| EG-Nummer | – | – |
| 206-445-9 (unspez.) | ||
| ECHA-Infocard | – | – |
| 100.005.860 (unspez.) | ||
| PubChem | 161166 | 1152206 |
| 846 (unspez.) | ||
| DrugBank | DB02070 | – |
| – (unspez.) | ||
| Wikidata | Q415768 | Q27077082 |
| Q32908783 (unspez.) | ||
Geschichte und Vorkommen
(S)-Kynurenin ist ein Stoffwechselintermediat beim Abbau des Tryptophans in vielen Lebewesen. Es wurde erstmals im Harn (lat. urina) von Hunden (gr. kyon) gefunden, wovon sich der Name der Verbindung ableitet. Adolf Butenandt untersuchte in seiner Inauguraldissertation 1940 und zusammen mit dem Genetiker Alfred Kühn den Einfluss des Kynurenin, das man zunächst für ein Hormon hielt, bei der Augenpigmentbildung von Insekten.[4]
(Bio-)Synthese und Merkmale
Beim Menschen verläuft ein wichtiger Stoffwechselweg vom L-Tryptophan über L-Kynurenin und seine Metaboliten hin zur Nicotinsäure. Die Synthese des L-Kynurenins in Lebewesen erfolgt mithilfe des Enzyms Arylformamidase, das die hydrolytische Abspaltung von Ameisensäure von N-Formylkynurenin katalysiert.[5] Im Urin weiblicher Masu-Lachse (Oncorhynchus masou) wirkt L-Kynurenin als Pheromon.[6] Racemisches Kynurenin kann technisch in mehreren Schritten in guter Ausbeute aus o-Chloranilin erhalten werden.[7] Das Oxidationsprodukt 3-Hydroxy-L-kynurenin ist auch ein Zwischenprodukt bei der Bildung von Ommochromen (Augenpigmenten) der Krebse und Insekten.[1]
Kynurenin wird seit langem wissenschaftlich erforscht, unter anderem in seiner Funktion als Präkursor des NMDA-Rezeptor-Antagonisten Kynurensäure.[8] Erhöhte Spiegel von L-Kynurenin im Gehirn durch Zufuhr von L-Kynureninsulfat zeigten in Tiermodellen neuroprotektive Effekte bei neurodegenerativen Erkrankungen.[8][9] Als Stoffwechselprodukt des Tryptophans im Organismus wird L-Kynurenin täglich in Mengen von ca. 1 mg im Harn ausgeschieden.[1]
Eigenschaften
L-Kynurenin bildet als Monohydrat farblose, blättchenförmige Kristalle, die sich wenig in Wasser, aber gut in Säuren lösen. Durch oxidative Desaminierung bildet sich beim Erhitzen aus L-Kynurenin die cyclische Kynurensäure, welche der eigentliche NMDA-Rezeptor-Antagonist ist.[10]
Störungen des Kynureninstoffwechsels
Eine Störung des Kynureninstoffwechsels an verschiedenen Stoffwechselschritten ist für zahlreiche Erkrankungen beschrieben und besitzt beim Menschen eine klinische Relevanz.[11][12][13][14][15] Typischerweise kommt es aufgrund Zytokin-induzierter Veränderungen im Tryptophan/Kynurenin-Stoffwechsel[16] zu einer Anhäufung (Akkumulation) jenes Stoffwechselprodukts, das im vorangegangenen Stoffwechselschritt erzeugt wurde und dem defekten bzw. dysregulierten Enzym eigentlich als Substrat dienen sollte. Je nach betroffenem Enzym sammeln sich somit jeweils andere Stoffwechselprodukte an. Von besonderer Bedeutung ist eine Akkumulation von Xanthurensäure, Chinolinsäure, Kynurenin, Kynureninsäure und Anthranilsäure.[17][18][19][20] Eine verminderte enzymatische Aktivität der Kynurenin-3-Monooxygenase (KMO-Mangel) führt typischerweise zu einer Anhäufung (Kumulation) von Kynurenin und einer Verschiebung des Tryptophanstoffwechsels hin zu Kynureninsäure, Anthranilsäure und deren weiteren Stoffwechselprodukten.[21][22][18][17] Da die Leistungsfähigkeit einiger der Enzyme auf dem Stoffwechselweg von Tryptophan über Kynurenin hin zur Nicotinsäure von Vitamin B6 abhängig sind, kann auch ein Vitamin B6-Mangel in manchen Fällen zu einer deutlich erhöhten Menge ausgeschiedenen Kynurenins im Harn führen.[10] Eine Folge der Dysregulation des Tryptophan-Kynureninstoffwechsels ist die vermehrte Bildung von Kynureninsäure, die wiederum eine Inhibition der Glutamat- und Dopaminfreisetzung im synaptischen Spalt zur Folge hat.[16]
Weblinks
- www.reactome.org: L-Kynurenine
Einzelnachweise
- Eintrag zu l-Kynurenin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Dezember 2014.
- Datenblatt L-Kynurenine, crystalline bei Sigma-Aldrich, abgerufen am 19. Februar 2013 (PDF).
- Beate Zsizsik: Oxidativer Metabolismus von Kynurensäure und ihren Analoga. (PDF) Dissertation an der Georg-August-Universität Göttingen, 2001.
- Wolfgang Schieder, Achim Trunk (Hrsg.): Adolf Butenandt und die Kaiser-Wilhelm-Gesellschaft: Wissenschaft, Industrie und Politik im Dritten Reich. (= Geschichte der Kaiser-Wilhelm-Gesellschaft im Nationalsozialismus. Band 7). Max-Planck-Gesellschaft zur Förderung der Wissenschaften, 2004, ISBN 3-89244-752-7, S. 178.
- E. M. Gál, A. D. Sherman: L-kynurenine: its synthesis and possible regulatory function in brain. In: Neurochem. Res. Band 5, Nr. 3, März 1980, S. 223–239, PMID 6154900.
- H. Yambe, S. Kitamura, M. Kamio u. a.: L-Kynurenine, an amino acid identified as a sex pheromone in the urine of ovulated female masu salmon. In: Proc. Natl. Acad. Sci. U.S.A. Band 103, Nr. 42, Oktober 2006, S. 15370–15374, doi:10.1073/pnas.0604340103, PMID 17030810, PMC 1622830 (freier Volltext).
- US-Patent 3766261
- K. Sas, H. Robotka, J. Toldi, L. Vécsei: Mitochondria, metabolic disturbances, oxidative stress and the kynurenine system, with focus on neurodegenerative disorders. In: J. Neurol. Sci. Band 257, Nr. 1–2, Juni 2007, S. 221–239, doi:10.1016/j.jns.2007.01.033, PMID 17462670.
- K. Sas, H. Robotka, E. Rózsa u. a.: Kynurenine diminishes the ischemia-induced histological and electrophysiological deficits in the rat hippocampus. In: Neurobiol. Dis. Band 32, Nr. 2, November 2008, S. 302–308, doi:10.1016/j.nbd.2008.07.013, PMID 18761090.
- Arnold Willmes: Taschenbuch chemische Substanzen: Elemente – Anorganika – Organika – Naturstoffe – Polymere. 3. Auflage. Harri Deutsch Verlag, 2007, ISBN 978-3-8171-1787-1, S. 648.
- Rossen Donev (Hrsg.): Inflammation in Neuropsychiatric Disorders. (= Advances in protein chemistry and structural biology. Band 88). Academic Press, 2012, ISBN 978-0-12-398314-5, S. 57 ff.
- Maria Holtze, Peter Saetre, Göran Engberg u. a.: Kynurenine 3-monooxygenase polymorphisms: relevance for kynurenic acid synthesis in patients with schizophrenia and healthy controls. In: J Psychiatry Neurosci. 37, 2012, S. 53–57.
- P. J. Hoekstra, G. M. Anderson, P. W. Troost: Plasma kynurenine and related measures in tic disorder patients. In: Eur Child Adolesc Psychiatry. 16 Suppl 1, 2007, S. 71–77.
- A. Buness, A. Roth, A. Herrmann, O. Schmitz, H. Kamp u. a.: Identification of Metabolites, Clinical Chemistry Markers and Transcripts Associated with Hepatotoxicity. In: PLoS ONE 9(5), 2014, e97249, doi:10.1371/journal.pone.0097249.
- Hirata Yukiko, Kawachi Takashi, Sugimura Takashi: Fatty liver induced by injection of L-tryptophan. In: Biochimica et Biophysica Acta. (BBA) - Lipids and Lipid Metabolism. Band 144, 1967, S. 233–241.
- Lucile Capuron, Andrew H. Miller: Immune System to Brain Signaling: Neuropsychopharmacological Implications. In: Pharmacol Ther. 130, 2011, S. 226–238. doi:10.1016/j.pharmthera.2011.01.014.
- Ikwunga Wonodi, O. Colin Stine, Korrapati V. Sathyasaikumar u. a.: Downregulated kynurenine 3-monooxygenase gene expression and enzyme activity in schizophrenia and genetic association with schizophrenia endophenotypes. In: Archives of General Psychiatry. Band 68, Nr. 7, 1. Juli 2011, ISSN 0003-990X, S. 665–674, doi:10.1001/archgenpsychiatry.2011.71.
- N. Müller, A. M. Myint, M. J. Schwarz: Inflammatory Biomarkers and Depression. In: Neurotox Res. 19, 2010, S. 308–318.
- Michael Maes, Robert Verkerkc, Stephania Bonaccorso: Depressive and anxiety symptoms in the early puerperium are related to increased degradation of tryptophan into kynurenine, a phenomenon which is related to immune activation. In: Life Sciences. 71, 2002, S. 1837–1848.
- Brian Campbell, Erik Charych, Anna Lee, Thomas Möller: Kynurenines in CNS disease: regulation byinflammatory cytokines. In: Frontiers in Neuroscience. Neuroendocrine Science. Band 8, 2014, Article 12.
- Norbert Müller: The impact of neuroimmune dysregulation on neuroprotection and neurotoxicity in psychiatric disorders - relation to drug treatment. In: Dialogues Clin Neurosci. 11, 2009, S. 319–332.
- Robert Dantzer, Jason C. O’Connor, Gregory G. Freund u. a.: From inflammation to sickness and depression: when the immune system subjugates the brain. Nature Publishing Group. Band 9, Januar 2008.