Kettenviper
Die Kettenviper (Daboia russelii) ist eine Art der Orientalischen Vipern (Daboia). Sie ist in zwei Unterarten in Asien von Indien über Teile Chinas bis nach Südostasien und Indonesien verbreitet. Die Kettenviper gilt wegen ihres extrem wirksamen Gifts und ihres häufigen Auftretens im Siedlungsbereich als gefährlichste Schlange Südostasiens; pro Jahr werden dieser Art etwa 900 Todesfälle zugeschrieben.
| Kettenviper | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Kettenviper (Daboia russelii) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Daboia russelii | ||||||||||||
| (Shaw & Nodder, 1797) |
Merkmale
Die Länge der Kettenviper variiert regional sehr stark. Inselpopulationen auf Sri Lanka bleiben im Regelfall relativ klein mit Durchschnittslängen von 0,90 m und Maximallängen von 1,5 m.[1] In China werden die Schlangen im Mittel etwa 1,0 bis 1,20 m lang mit einer Maximallänge von 1,67 m[2], und in Indien liegt die mittlere Länge bei 1,20 m und die Maximallänge bei 1,85 m.[3] Auf den relativ kurzen Schwanz entfällt dabei etwa ein Sechstel der Körperlänge, der Kopf einer 1,20 m langen Schlange ist etwa 5 Zentimeter lang. Der Körperbau ist im Vergleich zu anderen Vipern etwas schlanker. Der Kopf ist abgeflacht und annähernd dreieckig, er setzt sich deutlich vom Körper ab.

Die Schnauzenspitze ist aufgewölbt und vorn abgerundet, die darüberliegenden Nasenlöcher sind relativ groß und mit einem einzelnen, großen Nasenschild (Nasale) abgedeckt. Am vorderen Ende liegt das Nasorostrale an, welches wiederum über dem beinah quadratischen Rostrale am Vorderende der Schnauze liegt, die Supranasalia sind stark gebogen und mondsichelartig geformt. Der Oberkopf selbst ist mit kleinen und ungleichmäßigen Schuppen bedeckt. Die Überaugenschilde (Supraocularia) sind sehr schmal und ungeteilt, sie werden durch sechs bis neun Schuppen voneinander getrennt. Die Augen sind groß und jeweils von 10 bis 15 Schuppen umgrenzt. Die Iris ist goldgelb, die Pupille ist senkrecht. Unterhalb der Augen liegen drei bis vier Reihen von Unteraugenschilden (Subocularia) und darunter schließen sich die zehn bis zwölf Oberlippenschilde (Supralabialia) an, von denen der vierte und fünfte signifikant größer als die restlichen sind. An der Kopfunterseite befinden sich zwei Paar Kinnschilder, von denen der vordere deutlich vergrößert ist.
Die für Vipern typischen vorn im Oberkiefer stehenden Giftzähne sind ausklappbar und mit einem inneren Giftkanal ausgestattet (solenoglyphe Giftzähne). Sie sind bis zu 16 Millimeter lang, wobei mindestens zwei und maximal sechs Zahnpaare vorhanden sind. Die vordersten Zähne sind besonders stark ausgebildet und enthalten den eigentlichen Giftapparat. Sie werden bei Verlust durch die dahinterstehenden Zahnpaare, die ebenfalls mit einem Giftkanal ausgestattet sind, ersetzt. Außerdem besitzt die Art beidseitig 9 bis 10 Zähne auf dem Flügelbein (Pterygoid), 12 bis 13 auf der Mandibula und 3 Zähne auf dem Palatinum.
Der Körper ist flach gebaut und wird in der Mitte zylindrisch. Die Rückenschuppen sind stark gekielt, nur die unterste Reihe ist glatt ausgebildet. Der Rücken wird in der Körpermitte von 27 bis 33 Schuppenreihen abgedeckt, wobei die Anzahl regional unterschiedlich ist. Der Bauch zeigt 153–180 Bauchschuppen (Ventralia), der daran anschließende Analschild ist ungeteilt. Der kurze Schwanz hat 41 bis 68 paarige Subcaudalia.
Die Färbung variiert von einem dunklen Gelb über hellbraun bis erdbraun. Über den Rücken ziehen sich vom Kopf bis zum Schwanz drei Reihen von Fleckenbändern, wobei die beiden seitlichen Reihen in Einzelflecken aufgelöst sind. Dabei hat jeder Fleck eine dunkle Umrandung, die wiederum von einer Reihe heller Schuppen umrandet wird. Auf dem Kopf befinden sich zwei dunklere Flecken oberhalb der Augen, von denen sich eine V- oder X-förmige hellbraune bis rosafarbene Zeichnung zur Schnauzenspitze zieht. An den Kopfseiten zieht sich hinter den Augen ein bräunlicher Augenstreif nach hinten. Der Bauch ist weiß, gelblich oder rosafarben und kann ungleichmäßig dunkel gefleckt sein.
Insgesamt kann die Färbung und vor allem die Zeichnung der Tiere regional sehr unterschiedlich sein, daher wurden in der Vergangenheit fünf bis sieben Unterarten beschrieben. Nach einer umfassenden Untersuchung wurde diese Anzahl 1992 auf zwei derzeit anerkannte Unterarten reduziert, die westliche D. russelii russelii und die südöstliche D. russelii sublimitis.[4][5]
Verbreitung und Lebensraum
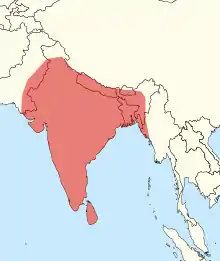

Die Kettenviper ist über ein sehr großes Gebiet im zentralen und südlichen Asien verbreitet. Sie kommt auf dem indischen Subkontinent mit Indien, Pakistan und Bangladesch, auf Sri Lanka, im südlichen China und auf Taiwan, in Myanmar, in Thailand sowie auf einigen Inseln Indonesiens vor. Dabei gibt es sowohl große, zusammenhängende Vorkommensgebiete als auch Regionen mit eher lückenhafter und isolierter Verbreitung. Besonders isoliert von anderen Vorkommen sind die Kettenvipern der indonesischen Inseln Komodo, Flores, Lembata und des südlichen Java, die mehr als 2000 Kilometer von den nächsten Festlandpopulationen in Thailand entfernt sind. Sumatra, Borneo, der größte Teil Javas und auch die malayische Halbinsel weisen keine Kettenvipern auf.[5]
Als Lebensraum bevorzugt die Art vor allem mäßig feuchte Habitate in niedrigeren Höhenlagen. Sie ist vor allem im Grasland und in Buschlandschaften zu finden, häufig zudem in Ruderalflächen, Randvegetation am Ufer von Flüssen sowie in Agrarflächen und Gärten. Dadurch findet man sie vor allem in Indien und einigen anderen Ländern häufig im Bereich menschlicher Ansiedlungen und landwirtschaftlich genutzter Gebiete. Die Art kommt auch in Gebieten mit dichtem Gebüsch vor, meidet jedoch geschlossene Waldgebiete mit dichter Vegetation, außerdem Sumpfland und permanent feuchte Gebiete. Die maximal besiedelten Höhenlagen liegen bei etwa 2300 bis 3000 Metern NN, meistens jedoch deutlich niedriger.
Lebensweise
Die Kettenviper ist im Normalfall nachtaktiv und hat ihre Hauptaktivitätszeit in der Zeit nach Sonnenuntergang, bei besonders kalter Witterung kann sich die Aktivität jedoch auch in den Tag verschieben. Sie ist primär bodenlebend und hält sich meistens in Gebüschen oder hohem Gras auf, wo sie durch ihre Zeichnung gut getarnt ist. Ihre Fortbewegung wird als träge und gleitend beschrieben, wobei besonders junge Tiere deutlich aktiver sind.
Bei Bedrohung rollt sich die Schlange zusammen und hebt den Oberkörper an, dabei zischt sie laut und deutlich hörbar. Aus dieser Position heraus stößt sie beim Biss mit großer Kraft vorwärts, wobei fast der gesamte Körper Bodenkontakt verlieren kann. Im Regelfall sind ausgewachsene Schlangen deutlich ruhiger und weniger reizbar als Jungschlangen.
Ernährung
Die Nahrung der Kettenviper besteht vor allem aus Kleinsäugern wie verschiedenen Ratten oder Mäusen sowie aus Vögeln. Vor allem für Südindien wird eine Spezialisierung auf die Indische Rennmaus beschrieben. Ansonsten reicht das sehr breite Spektrum an potentiellen Beutetieren von den bereits genannten Kleinsäugern bis hin zu Hauskatzen, Skorpionen und anderen Gliederfüßern. Jungtiere jagen hauptsächlich Eidechsen und auch Insekten. Vor allem aufgrund der dort häufig vorkommenden Mäuse leben die Schlangen oft auf Feldern und in der Nähe menschlicher Behausungen, wodurch es vergleichsweise häufig zum Aufeinandertreffen von Mensch und Kettenviper kommt.
Die Schlange pirscht sich an ein potenzielles Beutetier an und stößt dann in einem geeigneten Moment zu. Nach dem Biss zieht sie sich sofort wieder zurück und wartet, bis das Beutetier verendet ist. Die Beute wird dann mit dem Kopf voran verschlungen.
Fortpflanzung und Entwicklung
Die Paarung der Kettenviper erfolgt im Regelfall von April bis Juli. Die Jungtiere werden von Mai bis November geboren, wobei die meisten Geburten im Juni und im Juli zu verzeichnen sind. Die Schlange ist lebendgebärend (ovovivipar) und bringt 20 bis 40 Jungschlangen zur Welt, die größten dokumentierten Würfe bestanden aus etwa 65 Jungschlangen. Die Jungtiere sind bei der Geburt zwischen 215 und 260 Millimeter lang. Die Geschlechtsreife wird nach zwei bis drei Jahren mit etwa einem Meter Körperlänge erreicht.
Systematik
→ Hauptartikel: Orientalische Vipern#Systematik
Die Kettenviper wurde von George Shaw und Frederick Polydore Nodder 1797 erstmals wissenschaftlich als Coluber russelii beschrieben und damit zu den damals bekannten Nattern gestellt. Namensgeber war der Herpetologe Patrick Russell (1726–1805), der als Autor der Bücher An Account of Indian Serpents (1796) und A Continuation of an Account of Indian Serpents (1801) bekannt wurde. In ihrer Erstbeschreibung kam es allerdings zu einem Schreibfehler, da sie den Namen nur mit einem „l“ statt zweien schrieben. Kurz darauf kam die korrigierte Bezeichnung russelli, später zusätzlich russellii – beide sind jedoch nach der Prioritätsregel des International Code of Zoological Nomenclature (ICZN) ungültig. 1803 wurde die Art erstmals durch François Marie Daudin als Vipera daboia in die Gattung der Echten Ottern und Vipern eingeordnet und verblieb dort unter verschiedenen Synonymen bis in die 1990er Jahre, wobei sie auch mehrfach von verschiedenen Autoren der Gattung Daboia zugeschlagen wurde.

1992 erfolgte eine Revision der Gattung Vipera, bei der sie auf der Basis von biochemischen Merkmalen endgültig als einzige Art der Gattung Daboia zugeordnet wurde, dabei wurde außerdem die Gattung der Großvipern (Macrovipera) gebildet.[6]
Durch Lenk et al. 2001 wurde diese Zusammenstellung allerdings angezweifelt.[7] Auf molekularbiologischer Basis wurde die Zuordnung der afrikanischen Macrovipera sowie der Palästinaviper zur Gattung Daboia vorgeschlagen. Diese Ansicht wird bestätigt durch Garrigues et al. 2004: Wie bei Lenk et al. 2001 ist die Gattung der Großvipern in der aktuellen Zusammenstellung paraphyletisch, die Kettenviper bildet ein Taxon mit der Palästinaviper und den ehemaligen afrikanischen Großvipernarten.[8] Mallow et al. 2003 ordnete entsprechend die Palästinaotter in die Gattung ein,[9] die Atlasotter wurde 2008 von Wüster et al. auf Basis der Ergebnisse von Lenk et al. zu Daboia gestellt.[10]
Gift

Zusammensetzung und Wirkung
Wie die meisten Viperngifte ist auch das Gift der Kettenviper vor allem hämotoxisch, es zerstört also vor allem Zellen des Bluts und die sie umgebenden Gewebe durch verschiedene Proteasen. Hämotoxine führen zu umfassenden Gewebezerstörungen, inneren Blutungen und Schwellungen sowie Nekrosen und sind sehr schmerzhaft. Zu den wirksamsten Bestandteilen des Gifts gehören bei der Kettenviper allerdings Proteine, die die Blutgerinnung unterdrücken und damit gemeinsam mit den gewebezerstörenden Anteilen innere Blutungen verursachen. Blutungen treten dabei unter der Haut, in Nasen- und Mundhöhle und vor allem auch in Darm und Gehirn des Opfers auf. Neben Gehirnblutungen ist ein akutes Nierenversagen durch Nierenblutungen die Hauptursache für den Tod der Opfer.
Die Zusammensetzung des Gifts ist je nach Population der Kettenviper sehr variabel und daher ist auch die Wirkung je nach Lokalität teilweise sehr unterschiedlich. Das Gift besteht zu etwa 57 bis 70 Prozent aus Proteinen, davon wiederum entfallen etwa 70 Prozent auf Phospholipase A2, von der allerdings sieben unterschiedliche Isoenzyme bestimmt werden konnten. Die Zusammensetzung des Gifts korreliert nach unterschiedlichen Untersuchungen weder mit der Lokalität noch mit dem Aussehen der Tiere. Bei Untersuchungen mit Antiveninen wurde festgestellt, dass diese durchaus bei weit auseinanderlebenden Populationen beider Unterarten wirken können, andererseits können die Antivenine bei einer Population wirksam sein und bei einer dicht benachbarten Populationen unwirksam.[5]
Die Wirkung des Kettenvipergifts ist sehr stark. Die letale Dosis LD50 bei Mäusen, denen das Gift intravenös gespritzt wurde, liegt bei nur 0,08 bis 0,31 Mikrogramm pro Gramm Körpergewicht. Wird das Gift in die Bauchhöhle gespritzt (intraperitoneal), reichen 0,4 Mikrogramm pro Kilogramm Körpergewicht als LD50. Bei den meisten Menschen sind Giftmengen von 40 bis 70 mg tödlich, wodurch das Gift im Vergleich zu fast allen landlebenden Schlangen wie den Kobras, Klapperschlangen, Kraits, Lanzenottern oder auch Mambas deutlich wirksamer ist. Bei einem durchschnittlichen Erstbiss gibt die Kettenviper etwa 72 mg Gift ab, bei Einzelexemplaren konnten jedoch auch 150 bis 250 mg Gift pro Biss festgestellt werden, dies entspricht dem Gesamtinhalt der Giftdrüsen der Tiere.[11]
Das Gift der Kettenviper (eng. Russell's viper venom) wird zur Diagnostik eines Antiphospholipid-Syndroms eingesetzt.[12] Hierbei aktiviert im Diluted Russel-Viper-Venom-Time-Test (dRVVT) das Schlangengift in-vitro die Gerinnung zum Nachweis eines Lupus-Antikoagulans.[13]
Epidemiologie
Entsprechend der Wirkung des Gifts und der häufigen Zusammentreffen zwischen Mensch und Kettenviper vor allem in der Nähe von Siedlungen oder auf landwirtschaftlich genutzten Flächen wird die Kettenviper als die gefährlichste Giftschlange Indiens und Südostasiens eingeschätzt. Pro Jahr werden der Kettenviper etwa 2000 Bisse und etwa 900 Todesfälle zugeschrieben.
In Indien wird die Art gemeinsam mit der Brillenschlange (Naja naja), der Sandrasselotter (Echis carinatus) und dem Indischen Krait (Bungarus caeruleus) zu den Big Four gestellt, den vier Schlangenarten, die allein fast 100 Prozent der Todesfälle Indiens durch Schlangenbisse verursachen. Hier stammen etwa 34 Prozent aller Schlangenbisse von der Kettenviper, und etwa 30 Prozent dieser Begegnungen enden tödlich. In Südchina dagegen stammt im Durchschnitt nur ein Biss unter 640 von der Kettenviper.[11]
Bedrohung und Schutz
Die Kettenviper ist nur in Teilen ihres Verbreitungsgebietes durch aktive Jagd bedroht, im größten Teil ist sie regelmäßig bis häufig anzutreffen. Die Jagd erfolgt dabei vor allem in den Gebieten, in denen ihre Haut zu Schlangenleder verarbeitet wird oder in denen sie wie andere Schlangen auch gegessen wird. Durch Lebensraumzerstörung ist die Kettenviper dagegen kaum betroffen, da sie sich auch in landwirtschaftlich genutzten Gebieten oder Gärten ansiedelt und nur in enger besiedelten Stadtgebieten keinen Lebensraum findet.
Quellen
Zitierte Quellen
Die Informationen dieses Artikels entstammen zum größten Teil den unter Literatur angegebenen Quellen, darüber hinaus werden folgende Quellen zitiert:
- Anslem de Silva: Venomous Snakes, their Bites and Treatment in Sri Lanka. In: P. Gopalakrishnakone, L. M. Chou: Snakes of Medical Importance. Venom and Toxin Research Group, National University of Singapur, 1990, ISBN 9971-62-217-3, S. 529.
- E. Zhao: Venomous Snakes of China. In: P. Gopalakrishnakone, L. M. Chou: Snakes of Medical Importance. Venom and Toxin Research Group, National University of Singapur, 1990, ISBN 9971-62-217-3, S. 247.
- T.S.N. Murthy: Venomous Snakes of Medical Importance in India (Part A). In: P. Gopalakrishnakone, L. M. Chou: Snakes of Medical Importance. Venom and Toxin Research Group, National University of Singapur, 1990, ISBN 9971-62-217-3, S. 290.
- W. Wüster, S. Otsuka, A. Malhotra, R.S. Thorpe: Population Systematics of Russell’s Viper: A Multivariate Study. In: Biological Journal of the Linnean Society 47 (1), 1992, S. 97–113.
- Paul J. Belt, Anita Malhotra, Roger S. Thorpe, David A. Warrell, Wolfgang Wüster: Russel’s viper in Indonesia: snakebite and systematics. Symp zool. Soc. London 70, 1997, S. 219–234.
- H.-W. Herrmann, U. Joger, G. Nilson: Phylogeny and systematics of viperine snakes. III: resurrection of the genus Macrovipera (Reuss, 1927) as suggested by biochemical evidence. Amphibia-Reptilia, 13, 1992, S. 375–392.
- P. Lenk, S. Kalayabina, M. Wink, U. Joger: Evolutionary relationships among the true vipers (Reptilia: Viperidae) inferred from mitochondrial DNA sequences. In: Molecular Phylogenetics and Evolution 19, 2001, S. 94–104 (PDF; 140 kB).
- Thomas Garrigues, Catherine Dauga, Elisabeth Ferquel, Valérie Choumet und Anna-Bella Failloux: Molecular phylogeny of Vipera Laurenti, 1768 and the related genera Macrovipera (Reuss, 1927) and Daboia (Gray, 1842), with comments about neurotoxic Vipera aspis aspis populations. In: Molecular Phylogenetics and Evolution 35 (1), 2005, S. 35–47.
- David Mallow, David Ludwig, Göran Nilson: True Vipers. Natural History and Toxinology of Old World Vipers. Krieger Publishing Company Malabar, Florida 2003, ISBN 0-89464-877-2, S. 141–159.
- Wolfgang Wüster, Lindsay Peppin, Catharine E. Pook, Daniel E. Walker: A nesting of vipers: Phylogeny and historical biogeography of the Viperidae (Squamata: Serpentes). In: Molecular Phylogenetics and Evolution 49, 2008, S. 445–459.
- Alle Zahlenwerte nach Mallow et al. 2003
- David Garcia, Doruk Erkan: Diagnosis and Management of the Antiphospholipid Syndrome. In: New England Journal of Medicine. Band 378, Nr. 21, 24. Mai 2018, ISSN 0028-4793, S. 2010–2021, doi:10.1056/NEJMra1705454 (nejm.org [abgerufen am 17. November 2020]).
- Emmanuel J. Favaloro: The Russell viper venom time (RVVT) test for investigation of lupus anticoagulant (LA). In: American Journal of Hematology. Band 94, Nr. 11, 2019, ISSN 1096-8652, S. 1290–1296, doi:10.1002/ajh.25606 (wiley.com [abgerufen am 17. November 2020]).
Literatur
- David Mallow, David Ludwig, Göran Nilson: True Vipers. Natural History and Toxicology of Old World Vipers. Krieger Publishing Company Malabar, Florida 2003, ISBN 0-89464-877-2, S. 150–159.
- J. C. Daniels: Book of Indian Reptiles and Amphibians. Oxford University Press, 2002, ISBN 0-19-566099-4, S. 148–151.
- Muhammad Sharif Khan: Die Schlangen Pakistans. Frankfurter Beiträge zur Naturkunde, Band 15, Edition Chimaira. Frankfurt am Main 2002, ISBN 3-930612-43-7, S. 182–183.