Kaliumoxalat
Kaliumoxalat ist eine kristalline chemische Verbindung, die in Form ihres Hydrates oder wasserfrei vorliegen kann. Oxalate sind die Salze der Oxalsäure (auch Kleesäure).
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
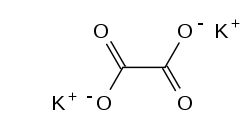 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Kaliumoxalat | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | K2C2O4 | ||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchloser Feststoff[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 184,23 g·mol−1 (als Monohydrat) | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
2,13 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt |
397 °C[3] | ||||||||||||||||||
| Löslichkeit |
gut in Wasser (360 g·l−1 bei 20 °C, wasserfreie Substanz)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−1346,0 kJ/mol[4] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen und Darstellung
.jpg.webp)
Kaliumoxalat kommt in der Natur in Waldsauerklee (Oxalis acetosella L.) in gelöster Form im Pflanzensaft vor. Synthetisch kann es durch Umsetzung äquivalenter Mengen Oxalsäure und Kalilauge oder Kaliumcarbonat (Pottasche) dargestellt werden.
Eigenschaften
Kaliumoxalat bildet als Monohydrat farblose Kristalle, die gut in Wasser löslich sind. Oberhalb von 100 °C geht die hydratisierte in die wasserfreie Form des Salzes über.[3] Das resultierende Anhydrat zeigt einen Schmelzpunkt bei 397 °C.[3] Bei weiterem Erhitzen erfolgt ab 500 °C eine Zersetzung unter Abspaltung von Kohlenmonoxid und Bildung von Kaliumcarbonat.[3]
Das Monohydrat kristallisiert in einem monoklinen Kristallgitter.[5] Für das Anhydrat sind zwei polymorphe Formen bekannt.[5] Die bei Raumtemperatur stabile Form bildet ein orthorhombisches Kristallgitter. Die Kristallstruktur der Hochtemperaturform ist tetragonal.[5]
Verwendung
Wasserlösliche Oxalate werden in der Galvanoplastik und in der analytischen Chemie zur Calciumbestimmung eingesetzt, da Calciumoxalat als schwerlösliches Calciumsalz aus einer Lösung ausgefällt wird. Viele Mittel zur Rostentfernung enthalten Oxalsäuresalze, weil diese Schwermetallionen komplexieren und damit wasserlöslich machen.
Sicherheitshinweise
Kaliumoxalat zeigt eine Reiz- bis Ätzwirkung auf Schleimhäute und Haut. Alle Kaliumoxalate sind aufgrund der Störung des Calciumstoffwechsels und damit des Hervorrufens von Nierenfunktionsstörungen in höheren Konzentrationen giftig.[2] Als Gegenmittel wird wässrige Magnesiumsalzlösung verabreicht, um das Entstehen der nierenblockierenden Calciumoxalat-Kristalle zu verhindern und die bereits entstandenen Kristalle in die besser wasserlösliche Form Magnesiumoxalat umzusetzen.
Siehe auch
Einzelnachweise
- Eintrag zu DIPOTASSIUM OXALATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 4. März 2020.
- Eintrag zu Kaliumoxalat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- Mohamed, M.A.; Galwey, A.K.; Halawy, S.A.: The activities of some metal oxides in promoting the thermal decomposition of potassium oxalate in Thermochim. Acta 387 (2002) 63–74, doi:10.1016/S0040-6031(01)00830-9.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-23.
- Masuda, Y.; Ito, R.; Matsuda, T.; Ito, Y.: The thermal phase transition of anhydrous potassium oxalate in Thermochim. Acta 131 (1988) 291–296, doi:10.1016/0040-6031(88)80083-2.
