Kaliumferrat
Kaliumferrat(VI) ist eine purpurrote bis violette, in reiner Form stabile chemische Verbindung.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
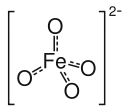 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Kaliumferrat | ||||||||||||
| Andere Namen |
Kaliumferrat(VI) | ||||||||||||
| Summenformel | K2FeO4 | ||||||||||||
| Kurzbeschreibung |
schwarzer Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 198,04 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit |
leicht löslich in Wasser[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Das Ferrat(VI)-Ion (FeVIO42−) enthält ein tetraedisch von vier Sauerstoffatomen umgebenes Eisenatom. Es handelt sich um einen Charge-Transfer-Komplex, wodurch die intensive Färbung erklärt wird.
In dieser Verbindung liegt Eisen in seiner höchsten vorkommenden Oxidationsstufe vor. Kaliumferrat ist daher ein starkes Oxidationsmittel, stärker als Kaliumpermanganat.
Gewinnung
Zur Darstellung im Labor wird zunächst eine Natriumhydroxidlösung durch Oxidation mit Chlorgas in das Hypochlorit überführt. Dieses wird dann mit einer Eisen(III)-nitratlösung umgesetzt und die erhaltene Ferrat(VI)-Lösung mit Natriumhydroxid gesättigt. Aus dieser Lösung wird schließlich mit konzentrierter Kaliumhydroxidlösung das Kaliumferrat gefällt. Durch Umfällen aus konzentrierter Kaliumhydroxidlösung kann die Verbindung in einer Reinheit von > 98 % erhalten werden[2]:
Andere Methoden benutzt statt des Chlors Kaliumperoxodisulfat als Oxidationsmittel oder verzichten ganz auf die Verwendung chemischer Oxidationsmittel und nutzen hierfür eine Elektrolyse.[2]
Eigenschaften
solution.png.webp)
Kaliumferrat kristallisiert in einer orthorhombischen Kristallstruktur mit der Raumgruppe Pnam (Raumgruppen-Nr. 62, Stellung 6). Die Gitterkonstanten sind a=769 pm, b=1033 pm und c=586 pm. Die Struktur ist isomorph zu der von Kaliumsulfat und Kaliumchromat.[3] Die Verbindung ist nur in trockenem Zustand haltbar. Stark verdünnte Lösungen sind einige Zeit haltbar, während sich konzentrierte Lösungen schnell zersetzen.[2]
Einzelnachweise
- Datenblatt Potassium ferrate(VI) bei Sigma-Aldrich, abgerufen am 6. April 2011 (PDF).
- Georg Brauer: Kaliumferrat(VI). In: Handbuch der Präparativen Anorganischen Chemie. Ferdinand Enke Verlag, Stuttgart 1954, S. 1124–1126.
- M. L. Hoppe, E. O. Schlemper, R. K. Murmann: Structure of Dipotassium Ferrate(Vl), in: Acta Crystallographica, 1982, B38, 2237–2239, doi:10.1107/S0567740882008395
