Kaliumdisulfat
Kaliumdisulfat oder Kaliumpyrosulfat K2S2O7 ist das Kaliumsalz der Dischwefelsäure.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
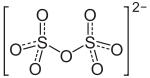 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Kaliumdisulfat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | K2S2O7 | ||||||||||||||||||
| Kurzbeschreibung |
weißer, geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 254,32 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
2,28 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt |
419 °C[2] | ||||||||||||||||||
| Löslichkeit |
löslich in Wasser[1]; reagiert unter Zersetzung | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Eigenschaften und Darstellung
Dikaliumdisulfat ist ein hygroskopischer, feuchtigkeitsempfindlicher, weißer und geruchloser Feststoff, welcher löslich in Wasser ist, wobei seine wässrige Lösung stark sauer reagiert.[1]
Es entsteht beim Erhitzen von Kaliumhydrogensulfat[3]:
- .
Bei weiterem Erhitzen zerfällt das Kaliumdisulfat bei ca. 600 °C in Kaliumsulfat und Schwefeltrioxid:
- .
Bei der Berührung mit Wasser zersetzt sich Kaliumdisulfat zu Schwefelsäure und Kaliumsulfat:
- .
Verwendung
Verwendet wird Kaliumdisulfat beispielsweise für einen sauren Aufschluss von Salzen bei Hitze:
- .
Das dabei gebildete Eisen(III)-sulfat ist wasserlöslich.
Einzelnachweise
- Eintrag zu Dikaliumdisulfat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- S. B. Rasmussen, K. M. Eriksen, G. Hatem, F. da Silva, K. Ståhl, R. Fehrmann: Conductivity, Thermal Measurements, X-ray Investigations, and Phase Diagram of the Na2S2O7-K2S2O7 System. In: The Journal of Physical Chemistry B. 105, 2001, S. 2747–2752, doi:10.1021/jp0039262.
- ASTM International: A Manual for the Chemical Analysis of Metals. ASTM International, S. 86 (eingeschränkte Vorschau in der Google-Buchsuche).

