Isomerisierung (Petrochemie)
Als Isomerisierung wird in der Petrochemie die Änderung der Atomfolge oder -anordnung eines gesättigten Kohlenwasserstoffs in ein anderes Isomer unter Beibehaltung seiner Molekülmasse mit dem Ziel einer Oktanzahlerhöhung bezeichnet. Der Gehalt an hochoktanigen aromatischen Komponenten in Kraftstoffen ist durch die Gesetzgebung limitiert, andererseits erfordern moderne Motoren eine höhere Kraftstoffqualität. Ziel der Isomerisierung ist daher die Erhöhung der Oktanzahl von n-Alkanen. So beträgt die Oktanzahl von n-Heptan 0, während das isomere 2,4-Dimethylpentan eine Oktanzahl von 80 aufweist.

Viele Isomere besitzen die gleiche oder eine nahezu gleiche Bindungsenergie, wodurch eine relativ freie Umwandlung stattfindet. Die Isomerisierung verläuft meist unter saurer Katalyse oder unter Wasserstoffdruck an sauren Edelmetallkatalysatoren.
Geschichte
Die Isomerisierung von n-Alkanen in iso-Alkane mittels Aluminiumchlorid-Katalysatoren beschrieben Costin Nenitzescu und Alexander Drâgan erstmals im Jahr 1933.[1] Sie fanden, dass die Isomerisierung bei längerkettigen Alkanen gegenüber Crack-Reaktionen in den Hintergrund trat. Während n-Butan weitgehend ohne Verlust in iso-Butan isomerisiert werden konnte, war diese Rate beim n-Heptan schon sehr gering.[2]
Bei der Überprüfung der Versuche zeigte sich, dass reines Aluminiumchlorid bei der Isomerisierung keine Wirkung zeigte. Die Gegenwart von Promotoren wie Chlorwasserstoff, Spuren von Chloralkanen und die Gegenwart von Olefinen war notwendig, um eine Isomerisierung zu erzielen.[3][4]
Mechanismus
Die Isomerisierung verläuft unter Säurekatalyse über einen Carbeniumionen-Mechanismus:
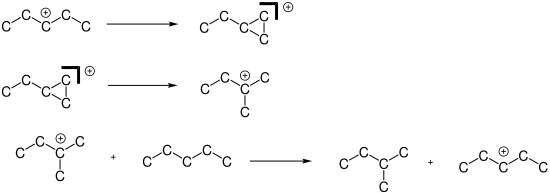
Der Mechanismus erklärt die notwendige Anwesenheit von Chlorwasserstoff und Olefinspuren, ohne die die Reaktion nicht abläuft. Olefin-Konzentrationen von 0,01 % sind dabei ausreichend:[5]
Die Olefine können sich während der Reaktion durch Crackreaktionen aus Alkanen bilden.
Die Isomerisierung der niedermolekularen Alkane ist eine Gleichgewichtsreaktion. Herbert Koch gelang die Isomerisierung von n-Hexan mit Aluminiumchlorid und Chlorwasserstoff bei Raumtemperatur. Dabei wurde die folgende Gleichgewichtszusammensetzung gefunden:[6]
- Gleichgewichtszusammensetzung der Hexanisomere bei 20 °C
| Chemischer Name |
Mol.% |
|---|---|
| n-Hexan | 4 |
| 2-Methylpentan | 23 |
| 3-Methylpentan | 10 |
| 2,2-Dimethylbutan | 56 |
| 2,3-Dimethylbutan | 7 |
Prozess
Versuche zur rein thermischen Isomerisierung von n-Butan und n-Pentan bei 700 °C führten selbst bei sehr kurzen Verweilzeiten nur zum Cracken. Um eine Isomerisierung zu höheroktanigen Produkten zu erzielen, ist der Einsatz eines Katalysators notwendig. Es handelt sich um eine Gleichgewichtsreaktion, bei der sich je nach Temperatur ein Gleichgewicht zwischen den verschiedenen Isomeren einstellt.[7]
Die Isomerisierung von Leichtbenzin mit den Bestandteilen n-Pentan und n-Hexan, wird industriell in großem Umfang betrieben, um die Oktanzahl zu steigern. Dazu werden bifunktionelle Katalysatoren verwendet, die sowohl über saure als auch über hydrieraktive, metallische Platin- oder Palladium-Zentren verfügen. Neben den Isomerisierungsprodukten bilden sich beim Prozess durch Crackreaktionen auch kürzerkettige Alkane und Olefine:
Zur Vermeidung von Crack- und Verkokungsreaktionen wird der Prozess oft unter Wasserstoffdruck durchgeführt.[8] Entstehende Olefine werden dabei wieder zum Alkan hydriert.
Bei der Isomerisierung von n-Pentan bildet sich vor allem Isopentan (2-Methylbutan). Neopentan (2,2-Dimethylpropan) bildet sich nicht. Die Isomerisierung von n-Hexan unter ähnlichen Bedingungen dagegen liefert neben den Methylpentanen in großen Mengen Neohexan (2,2-Dimethylbutan), das ein quartäres Kohlenstoffatom aufweist.[9]
- Tabelle der Research- und Motoroktanzahl einiger Hexanisomere
| Chemischer Name |
ROZ | MOZ |
|---|---|---|
| n-Hexan | 24,8 | 26,0 |
| 2-Methylpentan | 73,4 | 73,5 |
| 3-Methylpentan | 74 | 74 |
| 2,2-Dimethylbutan | 94 | 93 |
| 2,3-Dimethylbutan | 102 | 101 |
| Cyclohexan | 83 | 77 |
Penex-Prozess
Der Penex-Prozess ist ein kontinuierliches katalytisches Verfahren zur Isomerisierung von Pentan und Hexan-Fraktionen. Der Prozess wurde 1958 von UOP LLC kommerzialisiert.[10] Als Katalysatoren werden chlorierte Aluminiumoxid-Festbettkatalysatoren verwendet. Die Oktanzahl von leichtem Straight-run-Naphtha wird pro Verfahrensschritt von 50 bis 60 auf etwa 82 bis 86 erhöht. Durch die Abtrennung von niedrigoktanigen Komponenten durch Destillation oder Molsiebe kann die Oktanzahl auf etwa 91 bis 93 Einheiten verbessert werden. Die niedrigoktanigen Fraktionen werden wieder in den Prozess zurückgeführt.
Weblinks
Einzelnachweise
- Costin D. Nenitzescu, Alexander Drâgan: Über die Einwirkung von Aluminiumchlorid auf n-Hexan und n-Heptan, allein und in Gegenwart von Halogenderivaten. Eine Überführung von Paraffin- in Cycloparaffin-Kohlenwasserstoffe. In: Berichte der deutschen chemischen Gesellschaft (A and B Series). 66, 1933, S. 1892–1990, doi:10.1002/cber.19330661223.
- George Calingaert, Harold A. Beatty: The Isomerization of Normal Heptane. In: Journal of the American Chemical Society. 58, 1936, S. 51–54, doi:10.1021/ja01292a014.
- Herman Pines, R. C. Wackher: Isomerization of Alkanes. I. Effect of Olefins upon the Isomerization of n-Butane in the Presence of Aluminum Halide—Hydrogen Halide Catalyst. In: Journal of the American Chemical Society. 68, 1946, S. 595–599, doi:10.1021/ja01208a020.
- R. C. Wackher, Herman Pines: Isomerization of Alkanes. III. The Water—Aluminum Halide Reaction and Isomerization of n-Butane with the Reaction Product. In: Journal of the American Chemical Society. 68, 1946, S. 1642–1646, doi:10.1021/ja01212a084.
- H. S. Bloch, Herman Pines, Louis Schmerling: The Mechanism of Paraffin Isomerization. In: Journal of the American Chemical Society. 68, 1946, S. 153, doi:10.1021/ja01205a519.
- Herbert Koch, Herbert Richter: Das Isomerisierungsgleichgewicht der Hexane. In: Berichte der deutschen chemischen Gesellschaft (A and B Series). 77, 1944, S. 127–132, doi:10.1002/cber.19440770211.
- G. C. A. Schuit, H. Hoog, J. Verheus: Investigations into the isomerisation of aliphatic and alicyclic hydrocarbons. In: Recueil des Travaux Chimiques des Pays-Bas. 59, 1940, S. 793–810, doi:10.1002/recl.19400590817.
- S. T. Sie: Isomerization Reactions. In: G. Ertl, H. Knözinger, J. Weitkamp (Hrsg.): Handbook of Heterogeneous Catalysis, Vol. 4, Wiley-VCH, Weinheim, 1997, ISBN 978-3-527-29212-7. S. 1998–2017.
- B. L. Evering, E. L. d'Ouville: Experimental Equilibrium Constants for the Isomeric Hexanes. In: Journal of the American Chemical Society. 71, 1949, S. 440–445, doi:10.1021/ja01170a019.
- Isomerization, Honeywell UOP (Memento des Originals vom 12. Mai 2016 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.