Iopansäure
Iopansäure ist eine chirale Carbonsäure, die zu den Halogenaromaten zählt. In der Medizin wird das 1:1-Gemisch der (R)-Form und der (S)-Form als iodhaltiges Kontrastmittel eingesetzt.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
-Iopanoic_Acid_Structural_Formulae_V.svg.png.webp) | ||||||||||||||||||||||
| Stereoisomerengemisch – Strukturformel ohne Stereochemie | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Iopansäure | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C11H12I3NO2 | |||||||||||||||||||||
| Kurzbeschreibung |
weißes bis gelblichweißes Pulver[1] mit leicht aromatischem Geruch[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
V08AC06 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 571 g·mol−1 | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
4,8[3] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Gewinnung und Darstellung
Eine Mischung von m-Nitrobenzaldehyd, n-Buttersäureanhydrid und Natriumbutyrat wird durch Erhitzen in Xylol zu m-Nitro-α-ethyl-zimtsäure umgesetzt, welches durch Reduktion mit Wasserstoff und Iodierung mit Iodmonochlorid zu Iopansäure umgesetzt wird.[4]
Eigenschaften
Iopansäure ist ein lichtempfindliches, weißes bis gelblichweißes Pulver mit leicht aromatischem Geruch.[2]
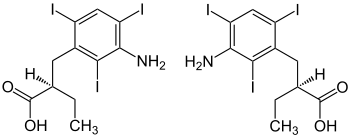
Enantiomere der Iopansäure: (R)-Form (links) und (S)-Form (rechts)
Einzelnachweise
- Europäisches Arzneibuch, 6. Ausgabe, Deutscher Apotheker Verlag, Stuttgart 2008, ISBN 978-3-7692-3962-1, S. 2885–2886.
- Eintrag zu Iopanoic Acid bei TCI Europe, abgerufen am 30. April 2017.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Dissociation Constants of Organic Acids and Bases, S. 8-49.
- David B. Troy: Remington: the science and practice of pharmacy. 2005, ISBN 978-0-7817-4673-1 (Seite 1266 in der Google-Buchsuche).
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. The authors of the article are listed here. Additional terms may apply for the media files, click on images to show image meta data.