Indolamin-2,3-Dioxygenase
Indolamin-2,3-Dioxygenase (IDO) ist das Enzym, das Tryptophan zu N-Formylkynurenin abbaut. Im Gegensatz zur Tryptophan-2,3-Dioxygenase (TDO) wird IDO in allen Gewebetypen des menschlichen Körpers produziert, besonders aber in den Tonsillen und der Plazenta, wo der Abbau von Tryptophan einen über den normalen Katabolismus hinausgehenden Zweck hat: Unterstützung des Immunsystems bei Infektionen einerseits, und Verhinderung der Abstoßung des Fetus andererseits. Durch ihre immunsuppressive Wirkung ist sie ein vielversprechendes Target, um eine längere Akzeptanz von Transplantaten zu erreichen. Umgekehrt könnte ihre Hemmung die Tumorbekämpfung verbessern.[1][2][3]
| Indolamin-2,3-Dioxygenase | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 403 Aminosäuren | |
| Kofaktor | Häm | |
| Bezeichner | ||
| Gen-Namen | INDO IDO; IDO-1; | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.13.11.52, Dioxygenase | |
| Reaktionsart | Oxidation mit Einbau von zwei Sauerstoff-Atomen | |
| Substrat | L-Tryptophan + O2 | |
| Produkte | N-Formylkynurenin | |
| Vorkommen | ||
| Homologie-Familie | Indolamin-2,3-Dioxygenase | |
| Übergeordnetes Taxon | Pilze, Tiere | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 3620 | 15930 |
| Ensembl | ENSG00000131203 | ENSMUSG00000031551 |
| UniProt | P14902 | P28776 |
| Refseq (mRNA) | NM_002164 | NM_001293690 |
| Refseq (Protein) | NP_002155 | NP_001280619 |
| Genlocus | Chr 8: 39.9 – 39.93 Mb | Chr 8: 24.58 – 24.6 Mb |
| PubMed-Suche | 3620 | 15930 |
Das INDO-Gen entstand wahrscheinlich durch Kopie des TDO2-Gens.[4]
Katalysierte Reaktion
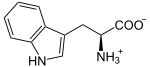 + O2
+ O2 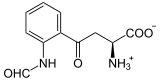
L-Tryptophan wird zu N-Formyl-L-kynurenin oxidiert. Als Substrat wird auch D-Tryptophan akzeptiert. Auch Superoxid kann als Sauerstoffdonor agieren.[5][6]
Medizinische Bedeutung
Funktionen im Immunsystem
Sowohl die immunsuppressive als auch die immununterstützende Funktion der IDO erklären sich aus dem hohen Wert der essentiellen Aminosäure Tryptophan, die besonders während der Aktivierung von T-Zellen, aber auch von eindringenden Fremdzellen benötigt wird. Mit dem rapiden Abbau allen Tryptophans durch IDO wird in der lokalen Umgebung die Proteinsynthese effektiv lahmgelegt. Zusätzlich aktivieren die entstehenden Abbauprodukte die Erzeugung regulatorischer T-Zellen, die letztendlich für die Immunsuppression verantwortlich sind.[7]
Neurophysiologie
Mit Indolamin-2,3-Dioxygenase (IDO) und Tryptophan-2,3-Dioxygenase (TDO) assoziierte Veränderungen des Tryptophanstoffwechsels sind für die neuropsychiatrische Forschung von Bedeutung.[8] Veränderungen von enzymatischen Aktivitäten entlang des Tryptophan-Kynurenin Stoffwechselweges sind für zahlreiche Störungsbilder beschrieben.[9][10] So kann die IDO insbesondere die Aktivität der Kynureninformidase und der Kynurenin-3-Monooxygenase verändern.[11][12][13] Typischerweise kommt es dadurch zu einer Anhäufung (Kumulation) von Kynurenin und einer Verschiebung des Tryptophanstoffwechsels hin zu Kynurensäure, Anthranilsäure und deren weiteren Stoffwechselprodukten.[14][15] Solche Veränderungen sind für Krankheiten des Gehirns (neurologische und psychiatrische Erkrankungen wie bspw. Schizophrenie und Ticstörungen)[16][17][18][19][20][21] und der Leber[22][23] beschrieben. Eine häufige Konstellation bei verschiedenen entzündlichen (z. B. Rheumatoide Arthritis), neuropsychiatrischen und malignen Erkrankungen ist eine gleichzeitig erhöhte Kynurenin/Tryptophan ratio durch Akkumulation von Kynurenin vor dem nächsten Stoffwechselschritt, der Hydroxylierung zu 3-Hydroxykynurenin infolge Katalysierung durch Kynurenin-3-Monooxygenase (KMO).[24][25]
Immuntoleranz in Lymphknoten
Lymphknoten, die stromabwärts von einem Tumor liegen, sind sozusagen privilegiert; durch sie strömen besonders viele Tumorantigene. Es ist wichtig, dass in diesem Bereich die Immunantwort nicht überschießt, da sonst viel normales Gewebe darunter zu leiden hätte. Aus diesem Grund wird vom Körper in solchen Lymphknoten die Produktion von IDO verstärkt, um die Immunantwort zu dämpfen. Dies kann andererseits dazu führen, dass auch in Tumorgewebe verstärkt IDO produziert wird und dann Tumorantigene nicht mehr präsentiert und daher im weiteren Verlauf nicht als fremd erkannt werden. Tatsächlich wird IDO in mehreren Krebszelllinien überexprimiert. Man versucht daher, eine bessere Krebsbekämpfung durch Hemmung der IDO zu erreichen.[26]
Derselbe Mechanismus ist die Ursache, wenn chronische Infektionen lokales Tumorwachstum erleichtern, denn auch hier produzieren die stromabwärts gelegenen Lymphknoten unterhalb des Infektionsherds vermehrt IDO und verhindern dadurch eine vollständige Immunantwort durch T-Zellen. Mäuse mit verringerter IDO-Produktion zeigten dieses Phänomen nicht.[27]
Regulation
Die Produktion von IDO wird durch gamma-Interferon und Lipopolysaccharide stimuliert. Die krebshemmende Wirkung von Curcumin ist zumindest teilweise auf die Unterbrechung dieses Signalwegs und folgende Hemmung der IDO zurückzuführen. Der Signalweg scheint auch eine Rolle bei der Etablierung einer HIV-Infektion zu spielen.[31][32][33]
Als Hemmstoffe von IDO sind 1-L-Methyltryptophan, das Alkaloid Exiguamin A und Derivate von Menadion bekannt.[34][35][36]
Weblinks
- tryptophan + O2 => N-formylkynurenine [IDO] reactome.org
Einzelnachweise
- BioGPS Eintrag
- OMIM-Eintrag
- J Quan, PH Tan, A MacDonald, PJ Friend: Manipulation of indoleamine 2,3-dioxygenase (IDO) for clinical transplantation: promises and challenges. In: Expert Opin Biol Ther. 8, Nr. 11, November 2008, S. 1705–1719. doi:10.1517/14712598.8.11.1705. PMID 18847306.
- HJ Yuasa, M Takubo, A Takahashi, T Hasegawa, H Noma, T Suzuki: Evolution of vertebrate indoleamine 2,3-dioxygenases. In: J. Mol. Evol.. 65, Nr. 6, Dezember 2007, S. 705–714. doi:10.1007/s00239-007-9049-1. PMID 18026683.
- UniProt P14902
- Werner ER, Werner-Felmayer G: Substrate and cofactor requirements of indoleamine 2,3-dioxygenase in interferon-gamma-treated cells: utilization of oxygen rather than superoxide. In: Curr. Drug Metab.. 8, Nr. 3, April 2007, S. 201–203. PMID 17430107.
- W Chen, X Liang, AJ Peterson, DH Munn, BR Blazar: The indoleamine 2,3-dioxygenase pathway is essential for human plasmacytoid dendritic cell-induced adaptive T regulatory cell generation. In: J. Immunol.. 181, Nr. 8, Oktober 2008, S. 5396–5404. PMID 18832696.
- AJ Dunn, AH Swiergiel, R. de Beaurepaire: Cytokines as mediators of depression: what can we learn from animal studies? In: Neurosci Biobehav Rev., 2005, 29(4-5), S. 891–909.
- TJ Connor, N Starr, JB O’Sullivan, A. Harkin: Induction of indolamine 2,3-dioxygenase and kynurenine 3-monooxygenase in rat brain following a systemic inflammatory challenge: a role for IFN-gamma? In: Neurosci Lett., 2008 Aug 15;441(1), S. 29–34. doi:10.1016/j.neulet.2008.06.007. Epub 2008 Jun 7.
- JM. Loftis: Indolamine 2,3-dioxygenase regulation and neuropsychiatric symptoms. In: Psychoneuroendocrinology. 2013 Sep;38(9), S. 1829–1830. doi:10.1016/j.psyneuen.2013.05.020. Epub 2013 Jun 27.
- Norbert Müller: The impact of neuroimmune dysregulation on neuroprotection and neurotoxicity in psychiatric disorders – relation to drug treatment. In: Dialogues Clin Neurosci. 2009, 11, S. 319–332.
- Robert Dantzer, Jason C. O’Connor, Gregory G. Freund et al.: From inflammation to sickness and depression: when the immune system subjugates the brain. Nature Publishing Group. January 2008, Volume 9.
- N Müller, AM Myint, MJ Schwarz: Inflammatory Biomarkers and Depression. In: Neurotox Res., 19, 2010, S. 308–318.
- Ikwunga Wonodi, O. Colin Stine, Korrapati V. Sathyasaikumar et al.: Downregulated Kynurenine 3-Monooxygenase Gene Expression and Enzyme Activity in Schizophrenia and Genetic Association With Schizophrenia Endophenotypes. In: Arch Gen Psychiatry, 2011, 68(7), S. 665–674
- N Müller, D Krause, E Weidinger, M Schwarz: Immunological treatment options for schizophrenia. In: Fortschr Neurol Psychiatr., 2014 Apr;82(4), S. 210–219, doi:10.1055/s-0033-1355776.
- Maria Holtze, Peter Saetre, Göran Engberg et al.: Kynurenine 3-monooxygenase polymorphisms: relevance for kynurenic acid synthesis in patients with schizophrenia and healthy controls. In: J Psychiatry Neurosci., 2012; 37, S. 53–57.
- Brian M.Campbell, Erik Charych, Anna W. Lee, Thomas Möller: Kynurenines in CNS disease: regulation byinflammatory cytokines. Frontiers in Neuroscience. In: Neuroendocrine Science, 2014, Volume 8, Article 12.
- PJ Hoekstra, GM Anderson, PW Troost: Plasma kynurenine and related measures in tic disorder patients. In: Eur Child Adolesc Psychiatry, 2007 Jun, 16 Suppl 1, S. 71–77.
- Serdar M. Dursun, Gillian Farrar, Sheila L. Handley et al.: Elevated plasma kynurenine in Tourette syndrome. Molecular and Chemical Neuropathology 1994, 21: S. 55–60
- H. Rickards, S. M. Dursuna, G. Farrar: Increased plasma kynurenine and its relationship to neopterin and tryptophan in Tourette’s syndrome. In: Psychological Medicine, 26, 1996, S. 857–862
- Erik Kwidzinski: Beteiligung der Indolamin 2,3-Dioxygenase (IDO) an Immunregulation des zentralen Nervensystems. Dissertation, Humboldt-Universität zu Berlin, Medizinische Fakultät - Universitätsklinikum Charité, publiziert am 13. Februar 2006, urn:nbn:de:kobv:11-10059777
- A Buness, A Roth, A Herrmann, O Schmitz, H Kamp et al.: Identification of Metabolites, Clinical Chemistry Markers and Transcripts Associated with Hepatotoxicity. In: PLoS ONE 9, 2014, S. e97249. doi:10.1371/journal.pone.0097249
- Hirata Yukiko, Kawachi Takashi, Sugimura Takashi: Fatty liver induced by injection of L-tryptophan. In: Biochimica et Biophysica Acta (BBA) - Lipids and Lipid Metabolism. 144, 1967, S. 233–241.
- K. Schroecksnadel, S. Kaser, G. Neurauter et al.: Increased Degradation of Tryptophan in Blood of Patients with Rheumatoid Arthritis. In: The Journal of Rheumatology, 2003, 30, S. 9
- M Maes, R Verkerk, S Bonaccorso et al.: Depressive and anxiety symptoms in the early puerperium are related to increased degradation of tryptophan into kynurenine, a phenomenon which is related to immune activation. In: Life Sci., 2002, 71: S. 1837–1848.
- Katz JB, Muller AJ, Prendergast GC: Indoleamine 2,3-dioxygenase in T-cell tolerance and tumoral immune escape. In: Immunol. Rev.. 222, April 2008, S. 206–221. doi:10.1111/j.1600-065X.2008.00610.x. PMID 18364004.
- AJ Muller, MD Sharma, PR Chandler et al.: Chronic inflammation that facilitates tumor progression creates local immune suppression by inducing indoleamine 2,3 dioxygenase. In: Proc. Natl. Acad. Sci. U.S.A.. 105, Nr. 44, November 2008, S. 17073–17078. doi:10.1073/pnas.0806173105. PMID 18952840.
- P. B. Medawar: Some immunological and endocrinological problems raised by the evolution of viviparity in vertebrates. In: Symp. Soc. Exp. Biol., 1953, 7, S. 320–338.
- WD Billington: The immunological problem of pregnancy: 50 years with the hope of progress. A tribute to Peter Medawar. In: J. Reprod. Immunol.. 60, Nr. 1, Oktober 2003, S. 1–11. PMID 14568673.
- DH Munn, M Zhou, JT Attwood et al.: Prevention of allogeneic fetal rejection by tryptophan catabolism. In: Science. 281, Nr. 5380, August 1998, S. 1191–1193. PMID 9712583.
- YI Jeong, SW Kim, ID Jung et al.: Curcumin suppresses the induction of indoleamine 2,3-dioxygenase by blocking the JAK-PKC-delta -STAT1 signalling pathway in IFN-gamma -stimulated murine dendritic cells. In: J. Biol. Chem.. Dezember 2008. doi:10.1074/jbc.M807328200. PMID 19075017.
- K Schroecksnadel, C Winkler, ER Werner et al.: Interferon-gamma-mediated pathways and in vitro PBMC proliferation in HIV-infected patients. In: Biol. Chem.. November 2008. doi:10.1515/BC.2009.018. PMID 19040353.
- JC O’Connor, MA Lawson, C André et al.: Lipopolysaccharide-induced depressive-like behavior is mediated by indoleamine 2,3-dioxygenase activation in mice. In: Mol. Psychiatry. Januar 2008. doi:10.1038/sj.mp.4002148. PMID 18195714.
- S Lob, A Konigsrainer, R Schafer, HG Rammensee, G Opelz, P Terness: Levo- but not dextro-1-methyl tryptophan abrogates the IDO activity of human dendritic cells. In: Blood. 111, Nr. 4, Februar 2008, S. 2152–2154. doi:10.1182/blood-2007-10-116111. PMID 18045970.
- HC Brastianos, E Vottero, BO Patrick et al.: Exiguamine A, an indoleamine-2,3-dioxygenase (IDO) inhibitor isolated from the marine sponge Neopetrosia exigua. In: J. Am. Chem. Soc.. 128, Nr. 50, Dezember 2006, S. 16046–16047. doi:10.1021/ja067211+. PMID 17165752.
- S Kumar, WP Malachowski, JB DuHadaway et al.: Indoleamine 2,3-dioxygenase is the anticancer target for a novel series of potent naphthoquinone-based inhibitors. In: J. Med. Chem.. 51, Nr. 6, März 2008, S. 1706–1718. doi:10.1021/jm7014155. PMID 18318466.