Tryptophan-2,3-Dioxygenase
Tryptophan-2,3-Dioxygenase (TDO) ist ein Enzym, das L-Tryptophan durch Bindung an zwei Sauerstoffatome oxidiert. Dies ist der erste und gleichzeitig geschwindigkeitsbestimmende Reaktionsschritt im Abbau von Tryptophan. TDO kommt in den meisten Lebewesen vor. Im Menschen wird es hauptsächlich in der Leber produziert. Ein aktives TDO-Enzym besteht aus einem Tetramer und bindet zwei Moleküle Häm als Kofaktor im katalytischen Zentrum.[1][2]
| Tryptophan-2,3-Dioxygenase | ||
|---|---|---|
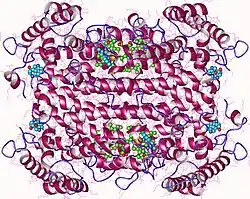 | ||
| Tryptophan-2,3-Dioxygenase homotetramer, Human nach PDB 5TIA --> | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 406 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homotetramer | |
| Kofaktor | Häm | |
| Bezeichner | ||
| Gen-Name | TDO2 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.13.11.11, Dioxygenase | |
| Reaktionsart | Oxidation mit Einbau von zwei Sauerstoff-Atomen | |
| Substrat | L-Tryptophan + O2 | |
| Produkte | N-Formylkynurenin | |
| Vorkommen | ||
| Homologie-Familie | Tryptophan-2,3-Dioxygenase | |
| Übergeordnetes Taxon | Lebewesen | |
TDO ergänzt sich im Körper mit der Indolamin-2,3-Dioxygenase (IDO), die denselben Abbau katalysiert; allerdings benutzt die IDO statt Sauerstoff Superoxid-Anionen und ist im Immunsystem und der Plazenta lokalisiert.
Katalysierte Reaktion
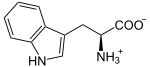 + O2
+ O2 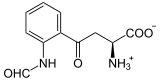
L-Tryptophan wird zu N-Formyl-L-kynurenin oxidiert. Das Hämmolekül stabilisiert dabei das Substrat (Tryptophan). Das Eisenatom des Häms ist, wie bei allen Dioxygenasen, an der Oxidation des Tryptophans beteiligt. Als Substrat werden auch andere Tryptamine wie Serotonin akzeptiert.[1]
Regulation
Die Transkription von TDO wird durch die Anwesenheit von Glucocorticoiden und Häm beeinflusst. Die Enzymaktivität der TDO wird durch Insulin moduliert und kann durch die Arzneistoffe Aciclovir, Tolmetin und Sulindac gehemmt werden.[3][4][5][6]
Weblinks
- reactome.org: tryptophan + O2 => N-formylkynurenine [TDO]
Einzelnachweise
- UniProt P48775
- BioGPS Eintrag
- Liao M, Pabarcus MK, Wang Y, et al: Impaired dexamethasone-mediated induction of tryptophan 2,3-dioxygenase in heme-deficient rat hepatocytes: translational control by a hepatic eIF2alpha kinase, the heme-regulated inhibitor. In: J. Pharmacol. Exp. Ther.. 323, Nr. 3, Dezember 2007, S. 979–89. doi:10.1124/jpet.107.124602. PMID 17761498.
- Isenović ER, Zakula Z, Koricanac G, Ribarac-Stepić N: Comparative analysis of tryptophan oxygenase activity and glucocorticoid receptor under the influence of insulin. In: Physiol Res. 57, Nr. 1, 2008, S. 101–7. PMID 17223727.
- Müller AC, Daya S: Acyclovir inhibits rat liver tryptophan-2,3-dioxygenase and induces a concomitant rise in brain serotonin and 5-hydroxyindole acetic acid levels. In: Metab Brain Dis. 23, Nr. 3, September 2008, S. 351–60. doi:10.1007/s11011-008-9095-4. PMID 18665439.
- Dairam A, Antunes EM, Saravanan KS, Daya S: Non-steroidal anti-inflammatory agents, tolmetin and sulindac, inhibit liver tryptophan 2,3-dioxygenase activity and alter brain neurotransmitter levels. In: Life Sci.. 79, Nr. 24, November 2006, S. 2269–74. doi:10.1016/j.lfs.2006.07.028. PMID 16952380.