Hexabenzocoronen
Hexabenzocoronen (genauer Hexa-peri-hexabenzocoronen) ist eine chemische Verbindung aus der Gruppe der polycyclischen aromatischen Kohlenwasserstoffe. Sie besteht aus einem Coronen-Ring mit einem Ring aus Benzolringen. Infolge der besonderen hochsymmetrischen Molekülstruktur ist die Verbindung äußerst beständig.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
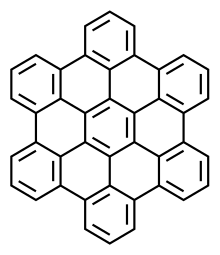 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Hexabenzocoronen | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C42H18 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 522,59 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Gewinnung und Darstellung
Für die Synthese von Hexabenzocoronen wurden seit dem frühen 20. Jahrhundert einige Syntheserouten beschrieben. So entwickelte Erich Clar 1958 als erste Darstellungsmethode eine Syntheseroute für Hexabenzocoronen ausgehend von 2:3-7:8-Dibenzo-peri-naphthalin, bei der die Ausgangsverbindung zunächst durch Bromierung und anschließender Erhitzung auf 153 °C zu Tetrabenzoperopyren umgesetzt wird und dann durch weitere Erhitzung auf 481 °C die Cyclodehydrierung zu Hexabenzocoronen.[3][4]
Bei einer anderen Synthesevariante von W. Schmidt wird ein Chinon-Derivat mit Phenyllithium umgesetzt und das Zwischenprodukt mit einer Schmelze aus Aluminiumtrichlorid und Natriumchlorid zunächst cyclisiert und danach bei 400 °C mit Kupfer aromatisiert.[5]
Alternativ kann Hexaphenylbenzol mittels Scholl-Reaktion oxidativ zur Titelverbindung umgesetzt werden.[6] Das Hexaphenylbenzol kann durch [2+2+2]-Cyclotrimerisierung aus Diphenylethin synthetisiert werden.[7]
Eigenschaften
Hexabenzocoronen ist ein Feststoff der eine monokline Kristallstruktur mit der Raumgruppe P21/a (Raumgruppen-Nr. 14, Stellung 3) besitzt.[8]
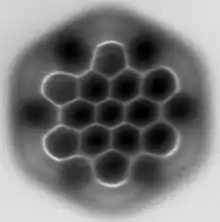
Seine Struktur wurde per Rasterkraftmikroskop sichtbar gemacht.[9]
Verwendung
Verbindungen auf Basis von Hexabenzocoronen werden zur Verbesserung von Solarzellen verwendet.[10]
Einzelnachweise
- Dongping Chen, Jethro Akroyd u. a.: Solid–liquid transitions in homogenous ovalene, hexabenzocoronene and circumcoronene clusters: A molecular dynamics study. In: Combustion and Flame. 162, 2015, S. 486, doi:10.1016/j.combustflame.2014.07.025.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Dieter A. Schlüter, Craig Hawker, Junji Sakamoto: Synthesis of Polymers New Structures and Methods. John Wiley & Sons, 2012, ISBN 3-527-64408-3, S. 377 (eingeschränkte Vorschau in der Google-Buchsuche).
- Sandeep Kumar: Chemistry of Discotic Liquid Crystals From Monomers to Polymers. CRC Press, 2016, ISBN 978-1-4398-1145-0, S. 168 (eingeschränkte Vorschau in der Google-Buchsuche).
- W. Hendel, Z.H. Khan, W. Schmidt: Hexa-peri-benzocoronene, a candidate for the origin of the diffuse interstellar visible absorption bands? In: Tetrahedron. 42, 1986, S. 1127, doi:10.1016/S0040-4020(01)87517-7.
- Sven Grätz, Doreen Beyer, Valeriya Tkachova, Sarah Hellmann, Reinhard Berger: The mechanochemical Scholl reaction – a solvent-free and versatile graphitization tool. In: Chemical Communications. Band 54, Nr. 42, 22. Mai 2018, ISSN 1364-548X, S. 5307–5310, doi:10.1039/C8CC01993B.
- Shingyo Sueyoshi, Tsuyoshi Taniguchi, Saki Tanaka, Hitoshi Asakawa, Tatsuya Nishimura: Understanding the Polymerization of Diphenylacetylenes with Tantalum(V) Chloride and Cocatalysts: Production of Cyclic Poly(diphenylacetylene)s by Low-Valent Tantalum Species Generated in Situ. In: Journal of the American Chemical Society. Band 143, Nr. 39, 6. Oktober 2021, ISSN 0002-7863, S. 16136–16146, doi:10.1021/jacs.1c06811.
- Richard Goddard, Matthias W. Haenel u. a.: Crystallization of Large Planar Polycyclic Aromatic Hydrocarbons: The Molecular and Crystal Structures of Hexabenzo[bc,ef,hi,kl,no,qr]coronene and Benzo[1,2,3-bc:4,5,6-b'c']dicoronene. In: Journal of the American Chemical Society. 117, 1995, S. 30, doi:10.1021/ja00106a004.
- L. Gross, F. Mohn u. a.: Bond-Order Discrimination by Atomic Force Microscopy. In: Science. 337, 2012, S. 1326, doi:10.1126/science.1225621.
- Henk H. Dam, Kuan Sun u. a.: Morphology Change and Improved Efficiency in Organic Photovoltaics via Hexa-para-hexabenzocoronene Templates. In: ACS Applied Materials & Interfaces. 6, 2014, S. 8824, doi:10.1021/am5015666.