Gassman-Reaktion
Die Gassman-Reaktion ist eine Namensreaktion der organischen Chemie. Sie wurde 1972[1] von Paul G. Gassman (1935–1993)[2] zum ersten Mal veröffentlicht. Mit Hilfe dieser Reaktion kann man ortho-alkylierte Aniline herstellen:[1]
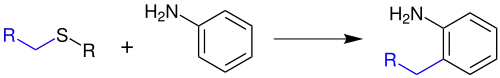
Durch eine leichte Abwandlung ist es möglich, auch Aniline mit einer Vinyl-, Alkyl- oder Benzaldehydgruppe in ortho-Position zu synthetisieren.[3] Die Gassman-Reaktion ist mit der Gassman-Indol-Synthese und mit der Gassman-Oxindol-Synthese verwandt.[1]
Mechanismus
Der hier beschriebene Mechanismus wurde von Zerong Wang[1] vorgeschlagen:

tert-Butylhypochlorit (1) wird homolytisch zu einem Chlor-Radikal und einem tert-Butyloxy-Radikal gespalten. Letzteres reagiert mit Anilin zu tert-Butanol und bildet ein radikalisches Anilin-Intermediat 2. Dieses rekombiniert mit dem zuvor entstandenen Chlor-Radikal zu N-Chloranilin (3). Versetzt man dieses mit einem organischen Sulfid, so erhält man das Sulfoniumkation 4. Diese arbeitet man mit Triethylamin auf, wodurch sich unter Abspaltung von Triethylaminhydrochlorid das Zwitterion 5 bildet. Nun findet ein intramolekularer nukleophiler Angriff statt, wobei das Imin 6 entsteht. Dann findet eine Eliminierungsreaktion statt, die zur Rearomatisierung des Ringes und zur Bildung des Anilins 7 führt. Durch Zugabe von Raney-Nickel erhält man unter Entschwefelung das ortho-substituierte Anilin 8.
Es gibt eine Modifizierung, in der anstelle des tert-Butylhypochlorits Sulfurylchlorid genutzt wird, um die notwendige N-Chlorierung von Anilin durchzuführen. Weitere Varianten ermöglichen es, mit Hilfe der Gassman-Reaktion auch para-substituierte Aniline zu erzeugen.[1]
Beispiele
Das nun folgende Beispiel soll die Anwendungsmöglichkeiten und den praktischen Nutzen der Gassman-Reaktion verdeutlichen.[3]
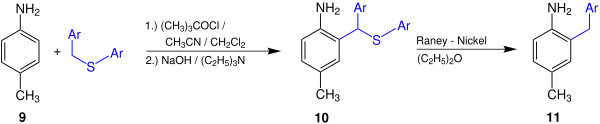
Hier wird exemplarisch die Reaktion von p-Toluidin 9 zum 2-Benzyl-4-methylanilin 11 dargestellt, wobei als Zwischenstufe das Anilinderivat 10 entsteht; Ar bezeichnet hierbei einen Phenylrest. Der hier exemplarisch verwendete Methylrest kann auch durch Wasserstoff, Chlor, eine Nitrogruppe oder einen Acetatrest ersetzt werden.[3]
Einzelnachweise
- nach: Z. Wang (Hrsg.): Comprehensive Organic Name Reactions and Reagents, 1 Volume Set, John Wiley & Sons, Hoboken, New Jersey 2009, S. 1198–1201, ISBN 978-0-471-70450-8.
- Paul G. Gassman. Abgerufen am 18. Juni 2013.
- Paul G. Gassman, H. Roger Drewes: The ortho functionalization of aromatic amines. Benzylation, formylation, and vinylation of anilines. In: Journal of the American Chemical Society. Band 100, Nr. 24, 1978, S. 7600–7610, doi:10.1021/ja00492a028.