Fürstner-Indol-Synthese
Die Fürstner-Indol-Synthese ist eine Namensreaktion der Organischen Chemie.[1] Sie wurde erstmals 1991 von Alois Fürstner als reduktive Cyclisierung von Oxoestern und Oxoamiden beschrieben.[2][3] Die Fürstner-Indol-Synthese stellt dabei eine Weiterentwicklung der McMurry-Reaktion dar, bei welcher eine Kupplung von Aldehyden oder Ketonen unter Zusatz eines Titanreagenzes erfolgt.[1][2]
Übersichtsreaktion
Beispielhaft wird die Reaktion an dieser Stelle anhand von N-(o-Acetylphenyl)-acetamid veranschaulicht. Alternativ lassen sich jeweils die endständigen Methylgruppen an den Carbonylgruppen durch organische Reste ersetzen. Die Verbindung wird unter Zusatz von Titan auf Graphit (als Reagenz) zu 2,3-Dimethylindol umgesetzt:[1][4]
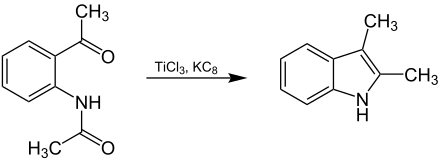
Das Reagenz wird dabei in situ über die Reaktion von Titan(III)-chlorid und Kaliumgraphit (als starkes Reduktionsmittel) unter Bildung von Kaliumchlorid hergestellt:[2][4]
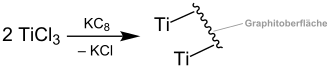
Die Reaktion lässt sich dabei beispielsweise in Lösungsmitteln wie THF, DMF oder Ethylacetat durchführen.[1] In der Literatur wird zudem über eine Anpassung der Reaktion durch die Verwendung von Zinkstaub, Titanchlorid in katalytischer Menge und Chlorsilanen gesprochen.[1][2] Dies ermöglicht die Rückgewinnung des Titanchlorids.[2]
Reaktionsmechanismus
Das Titan-Graphitreagenz lagert sich zunächst an die Carbonylgruppe des N-(o-Acetylphenyl)-acetamids (1) an.[1] In einem weiteren Schritt erfolgt der Ringschluss durch Angriff der Amidgruppe auf eins der Titanatome.[1] Abschließend erfolgt die Ausbildung des Indols (2) unter Abspaltung von Titanoxid und des Graphitrests, insofern ohne den Zusatz von Zinkstaub und Chlorsilanen gearbeitet wird.[1][2]

Siehe auch
Atomökonomie
Abgesehen von der Reaktionsvariante mit Chlorsilanen, fallen neben Resten an Graphit Metallabfälle in Form von Titanoxid an, wodurch von keiner sehr guten Atomeffizienz gesprochen werden kann. Selbst die katalytisch wirksame Variation der Reaktion erfordert den Zusatz von Chlorsilanen, welche (unter Abspaltung von Chlor und Aufnahme von Sauerstoff) als Nebenprodukte im Lauf der Reaktion anfallen.[2]
Einzelnachweise
- Daniel Zerong Wang: Comprehensive Organic Name Reactions and Reagents. Band 1. John Wiley & Sons, Inc., John Wiley & Sons, Inc., Hoboken, New Jersey 2009, ISBN 978-0-471-70450-8, S. 1170–1175, doi:10.1002/9780470638859.conrr197.
- Alois Fürstner, Achim Hupperts: Carbonyl Coupling Reactions Catalytic in Titanium and the Use of Commercial Titanium Powder for Organic Synthesis. In: Journal of the American Chemical Society. Band 117, Nr. 16, 1995, S. 4468–4475, DOI:10.1021/ja00121a004.
- Autoren Profil: Alois Fürstner. In: Angewandte Chemie International Edition. Band 50, Nr. 13, 2011, S. 2880–2882, DOI:10.1002/anie.201007191.
- Alois Fürstner, Denis N. Jumbam, Hans Weidmann: Titanium-induced syntheses of furans and indoles. In: Tetrahedron Letters. Band 32, Nr. 46, 1991, S. 6695–6696, DOI:10.1016/S0040-4039(00)93577-9.