Fukuyama-Indolsynthese
Die Fukuyama-Indolsynthese ist eine Namensreaktion der Organischen Chemie und wurde 1994 von dem japanischen Chemiker Tohru Fukuyama (* 1948) entdeckt.
Übersichtsreaktion
Die Reaktion dient der Synthese von Indolen durch radikalische Cyclisierung von ο-Isocyanostyrol-Derivaten-Reaktionsschema:[1]
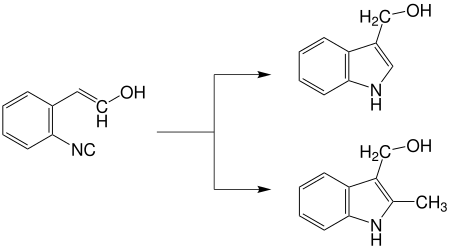
Bei der Fukuyama-Indolsynthese[2] werden das Zinn-Reagenz Tributylzinnhydrid (n-Bu3SnH) und Azobis(isobutyronitril) (AIBN) als Radikalstarter oder Triethylboran verwendet. Mit diesen Reagenzien können ο-Isocyanostyrol-Derivate zu Indolen umgesetzt werden, wobei bei Zugabe von Säure ein 3-substituiertes Indol und bei Zugabe von Halogenalkanen und Palladium(0) 2,3-disubstituierte Indole entstehen.
Mechanismus
Ein möglicher Mechanismus dieser radikalischen Cyclisierung wird in den wissenschaftlichen Veröffentlichungen von Tohru Fukuyama et al.[3] vorgestellt. Durch die Zugabe des AIBNs zum Tributylzinnhydrid entsteht ein Tributylzinn-Radikal, das einen mesomeriestabiliersten ο-Isocyanostyrol 1 radikalisch angreift. Es bildet sich ein α-Stannoimidoyl-Radikal 2, das durch intramolekularen Ringschluss und intramolekulare Protonenwanderung zum Radikal 3 reagiert. Durch weitere Zugabe von Tributylzinnhydrid kommt es zum Abbruch der radikalischen Prozesse und es bleibt 2-Stannylindol 4 als Hauptprodukte zurück. Je nach dem welche Reagienzien zu 4 hinzukommen, entsteht ein 3- oder ein 2,3-disubstituiertes Indol. Das 3-substituierte Indol erhält man, indem man 4 durch Zugabe einer Säure protoniert. Dann spaltet sich ein Tributylzinn-Kation ab und es entsteht das gewünschte Indol-Derivat 5.
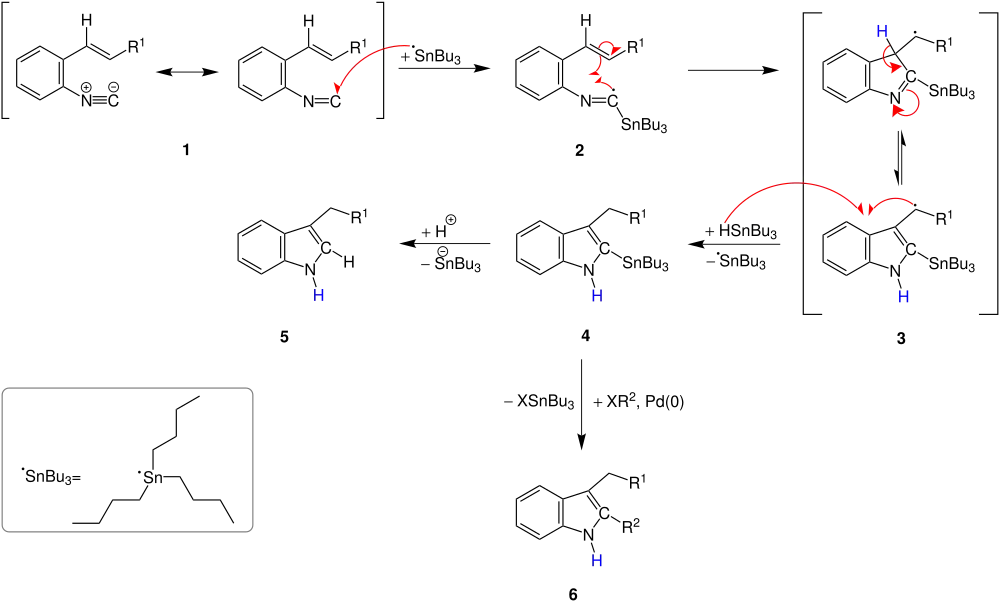
Zur Synthese von dem 2,3-disubstituierten Indol (6) benötigt man stattdessen eine Halogenverbindung (Rest R2= Cyclohexenyl-, Phenyl- und Butylgruppe)[2][3] und Palladium als Katalysator.

Als Rest R1 können verschiedene Ester- aber auch Alkylgruppen verwendet werden. Es handelt sich um eine Eintopfreaktion, bei der das Triethylboran nur bei cis-Isomeren zum Einsatz kommt und genauso wie beim Einsatz von AIBN eine Indol-Ausbeute von 93 % liefert.[2]
Einzelnachweise
- Gordon W. Gribble: Recent developments in indole ring synthesis—methodology and applications. In: Journal of the Chemical Society, Perkin Transactions 1. Nr. 7, 2000, S. 1045–1075, doi:10.1039/A909834H.
- Tohru Fukuyama, Xiaoqi Chen, Ge Peng: A Novel Tin-Mediated Indole Synthesis. In: Journal of the American Chemical Society. Band 116, Nr. 7, April 1994, S. 3127–3128, doi:10.1021/ja00086a054.
- Hidetoshi Tokuyama, Tohru Yamashita, Matthew T. Reding, Yosuke Kaburagi, Tohru Fukuyama: Radical Cyclization of 2-Alkenylthioanilides: A Novel Synthesis of 2,3-Disubstituted Indoles. In: Journal of the American Chemical Society. Band 121, Nr. 15, April 1999, S. 3791–3792, doi:10.1021/ja983681v.