Erlenmeyer-Synthese
Die Erlenmeyer-Synthese oder Erlenmeyer-Plöchl-Synthese ist eine Namensreaktion in der Organischen Chemie. Sie wurde nach dem deutschen Chemiker Emil Erlenmeyer jun. (1864–1921) benannt und ist eine Variante der Perkin-Reaktion. Durch die Erlenmeyer-Synthese können Azlactone (Oxazolone, das heißt Oxo-Derivate von Oxazolen) synthetisiert werden, indem aromatische Aldehyde mit einer aromatischen Carbonsäure (z. B. Hippursäure) in Gegenwart von Essigsäureanhydrid zur Reaktion gebracht werden.
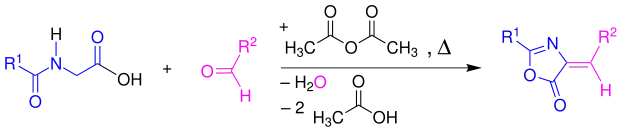
Die Erlenmeyer-Synthese ist noch unter weiteren Namen bekannt: Erlenmeyer-Plöchl-Reaktion, Erlenmeyer-Plöchl-Synthese und Erlenmeyer-Plöchl-Azlacton-Synthese.
Reaktionsmechanismus
Das Sauerstoffatom der Hydroxygruppe der Carbonsäure 1 greift das Essigsäureanhydrid zunächst nucleophil an. Essigsäure wird dabei abgespalten. Nach einer Keto-Enol-Tautomerie findet ein weiterer Angriff der Verbindung 3 auf den aromatischen Aldehyd statt, so dass die Verbindung 4 entsteht. Unter einer Wasserabspaltung und einer weiteren Tautomerie findet eine Cyclisierung statt. Danach wird erneut ein Essigsäuremolekül abgespalten und das gewünschte Azlacton 8 erhalten.[1]
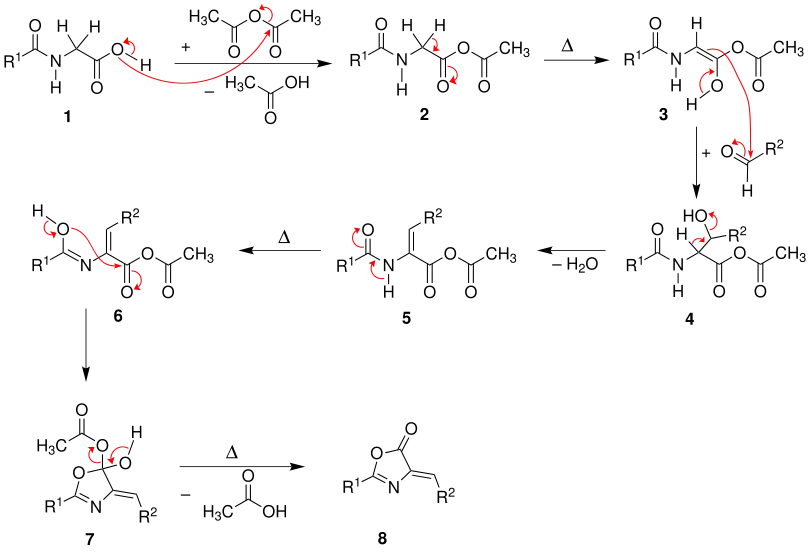
Darstellung von α-Ketosäuren
Aus Azlactonen lassen sich dann durch Verseifung α-Ketosäuren herstellen:
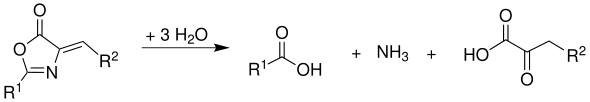
Darstellung von α-Aminosäuren
Erfolgt vor der Verseifung eine Hydrierung der C=C-Doppelbindung, so entstehen α-Aminosäuren:
Varianten
Verwendet man statt der Hippursäure Hydantoin oder Rhodanin, erhält man die Aminosäuren in höherer Ausbeute.
Eine Variante der Erlenmeyer-Synthese ist die Erlenmeyer-Bergmann-Plöchl-Synthese, die nach den Chemikern Emil Erlenmeyer, Max Bergmann und Josef Plöchl (* 1853)[2] benannt wurde.
Die Synthese beschreibt chemische Reaktionen, in denen Glycin in eine Reihe von Aminosäuren über Oxazolinon und Azlacton dargestellt werden kann.[3][4]
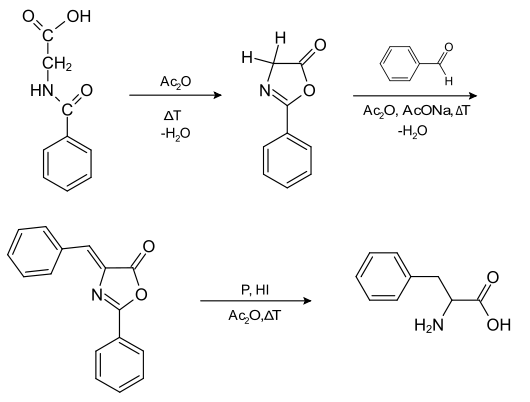
Hippursäure[5] geht in Gegenwart von Acetanhydrid eine Selbstkondensation zu 2-Phenyl-oxazol-5-on ein.[6] Dieses Zwischenprodukt hat zwei saure Protonen und reagiert mit Benzaldehyd, Acetanhydrid und Na-Acetat zu Azlacton. Dieses wiederum kann durch Reduktion zu Phenylalanin reagieren.[7]
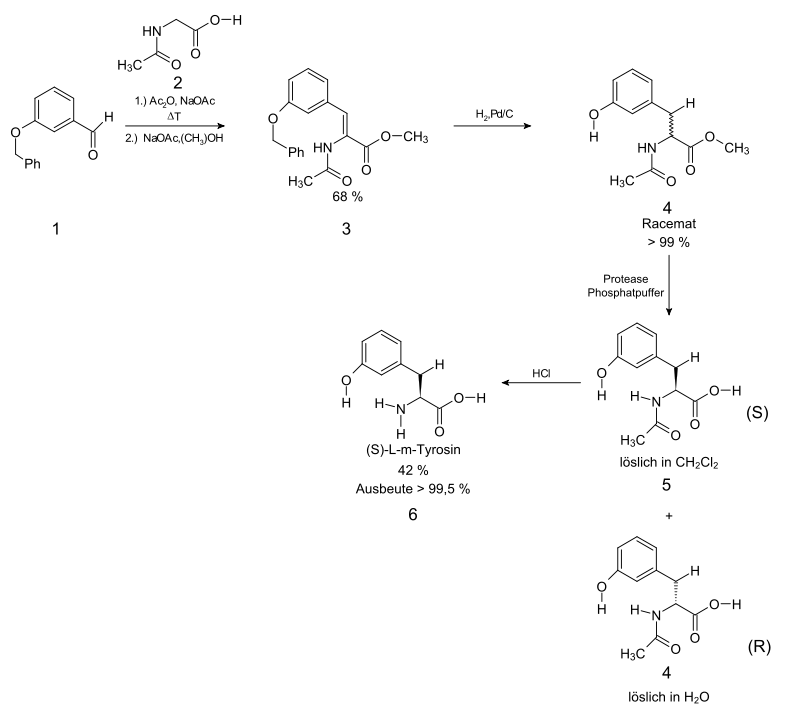
In einer Studie wurde die Erlenmeyer-Aminosäuren-Synthese als Kernsynthese von L-m-Tyrosin eingesetzt.[8]
Der Benzylether des 3-Hydroxybenzaldehyds reagiert mit 1 über das N-Acetylamid des Glycins 2, Acetanhydrid und Natriumacetat zum Azlacton (im Syntheseweg nicht dargestellt), welches eine Ringöffnung mit Natriumacetat in Methanol zur Dehydroaminosäure 3 erfährt. Die anschließende Hydrierung ergibt den (RS)-N-Acetyl-m-tyrosinmethylester 4 (die Benzylethergruppe wird hydrogenolytisch gespalten), ein Racemat. Ein spezielles Enzym ist in der Lage, nur den Methylester des (S)-Enantiomers 5 zu spalten, welches in Dichlormethan löslich ist. Zurück bleibt die wasserlösliche (R)-4. Der letzte Schritt ist die salzsaure Abspaltung der Acetylgruppe von 5, die (S)-m-Tyrosin 6 liefert.
Literatur
- Organikum. Johann Ambrosius Barth, Leipzig/Berlin/Heidelberg 1993, ISBN 3-335-00343-8, S. 461–462.
Einzelnachweise
- Z. Wang (Hrsg.): Comprehensive Organic Name Reactions and Reagents. Volume 1, Wiley, 2009, ISBN 978-0-471-70450-8 (3-Volume Set), S. 997.
- Josef Plöchl, Professor in Kaiserslautern, geboren 1853. Edvard Hjelt: Geschichte der organischen Chemie von ältester Zeit bis zur Gegenwart, Vieweg 1916, Personenregister.
- Plöchl J.: Über einige Derivate der Benzoylimdozimtsäure. In: Ber.. 17, 1884, S. 1623.
- Erlenmeyer, E. jun.: Ueber die Condensation der Hippursäure mit Phthalsäureanhydrid und mit Benzaldehyd. In: Justus Liebigs Annalen der Chemie. 275, 1893, S. 3. doi:10.1002/jlac.18932750102.
- A. W. Ingersoll, S. H. Babcock: Hippuric acid In: Organic Syntheses. 12, 1932, S. 40, doi:10.15227/orgsyn.012.0040; Coll. Vol. 2, 1943, S. 328 (PDF).
- G. E. VandenBerg, J. B. Harrison, H. E. Carter, B. J. Magerlein: 2-Phenyl-2-oxazolone In: Organic Syntheses. 47, 1967, S. 101, doi:10.15227/orgsyn.047.0101; Coll. Vol. 5, 1973, S. 946 (PDF).
- H. B. Gillespie, H. R. Snyder, R. M. Herbst, D. Shemin: dl-β-Phenylalanine In: Organic Syntheses. 19, 1939, S. 67, doi:10.15227/orgsyn.019.0067; Coll. Vol. 2, 1943, S. 489 (PDF).
- Cara E. Humphrey, Markus Furegati, Kurt Laumen, Luigi La Vecchia, Thomas Leutert, J. Constanze D. Müller-Hartwieg, Markus Vögtle: Optimized Synthesis of l-m-Tyrosine Suitable for Chemical Scale-Up. In: Organic Process Research & Development. 11, Nr. 6, 2007, S. 1069–1075, doi:10.1021/op700093y.