Emde-Abbau
Emde-Abbau ist eine Namensreaktion der Organischen Chemie und wurde 1906 von dem deutschen Chemiker Hermann Emde (1880–1935) entdeckt. Bei dieser Reaktion werden quartäre Ammoniumsalze reduktiv zu tertiären Aminen und Kohlenwasserstoffen (Alkane oder Alkene) gespalten.[1] Es ist eine Modifikation des Hofmann-Abbaus und wird deswegen auch Hofmann-Emde-Abbau genannt.[2]
Übersichtsreaktion
Die Entdeckung des Emde-Abbaus fand bei der Übertragung der Hydrierungsreaktion der Zimtsäure zu 3-Phenylpropionsäure in Vorhandensein von Natriumamalgam auf Amine statt. Hierfür hydrierte Emde das Cinnamyl-trimethylammoniumchlorid 1 mit Natriumamalgam und erhielt ein unerwartetes Ergebnis. Der Wasserstoff lagerte sich nicht an der C=C-Doppelbindung des Edukts an, sondern spaltete dieses an der Kohlenstoff-Stickstoff-Bindung, wobei Trimethylamin 2, 1-Propenylbenzol 3 und Salzsäure entstanden.[3][4]
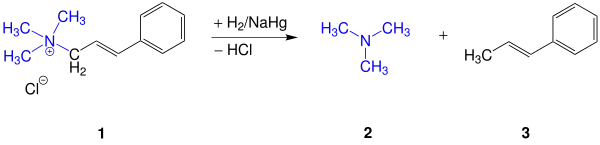
Später stellte Emde fest, dass der Emde-Abbau katalytisch mit Palladium oder Platin schonender ablaufen kann.[5] Weitere Untersuchungen zeigten, dass diese Abbaureaktion bei Ammoniumsalzen mit vier gesättigten Alkylgruppen nicht stattfindet.[6] Erst durch die Verwendung von Natrium in flüssigem Ammoniak oder Dioxan kann der Emde-Abbau bei solchen Salzen schließlich ablaufen.[7]
Mechanismus
Da noch zu wenig belastbare Kenntnisse zum Mechanismus des Emde-Abbaus vorliegen, gibt es nur Tendenzen wie dieser aussehen könnte. Dabei ist es abhängig, ob ein Alkan oder ein Alken als eines der Reaktionsprodukte entsteht. Bei der Verwendung von Natriumamalgam entstehen Alkene und beim Einsatz von Natrium im flüssigen Ammoniak entstehen über radikalische Zwischenstufen Alkane.[8]
Verwendung
Chemische Abbau-Reaktionen wie der Emde-Abbau dienen zur Strukturaufklärung von Alkaloiden. Durch die Identifizierung von Abbauprodukten können Rückschlüsse auf das vorliegende Alkaloid gezogen werden.[9] Speziell bei Molekülen, bei denen der Hofmann-Abbau nicht möglich ist wie beispielsweise bei 1,2,3,4-Tetrahydrodimethyl-chinoliniumchlorid, kann der Emde-Abbau angewendet werden. Hierbei entsteht das γ-Dimethylaminopropylbenzol:[10]
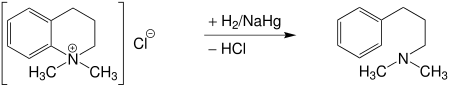
Siehe auch
Weblinks
Einzelnachweise
- E. Grovenstein, Jr., E. P. Blanchchard, Jr., D. A. Gorden, R. W. Stevenson: Carbanions. II. Cleavage of Tetraalkylammonium Halides by Sodium in Dioxane. In: J. Am. Chem. Soc. Band 81, 1959, S. 4842–4850, doi:10.1021/ja01527a023.
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, 2009, ISBN 978-0-471-70450-8, S. 989–991.
- H. Emde: Ueber Styrylaminbasen und deren Beziehungen zum Ephedrin und Pseudoephedrin. In: Archiv der Pharmazie. Band 244, 1906, S. 269–299, doi:10.1002/ardp.19062440405.
- H. Emde, H. Kull: Abbau quartärer Ammoniumverbindungen mit Natriumamalgam, eine Übersicht. In: Archiv der Pharmazie. Band 272, 1934, S. 469–481, doi:10.1002/ardp.19342721029.
- Organic Name Reactions. Merck, S. 145.
- Michael B. Smith: March's Advanced Organic Chemistry, John Wiley & Sons, 7. Auflage, 2013, S. 1548, ISBN 978-0-470-46259-1.
- H. Krauch, W. Kunz, E. Nonnenmacher: Reaktionen der organischen Chemie. WILEY-VCH Verlag, 1997, ISBN 978-3-527-29713-9, S. 3.
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, 2009, ISBN 978-0-471-70450-8, S. 989–991.
- Eberhard Breitmaier: Alkaloide. Vieweg & Teunber, 2008, ISBN 978-3-8348-0531-7, S. 7–8.
- Gurdeep Raj, Mathu Chhatwal: Organic Name Reactions and Molecular Rearrangements. KRISHNA Prakashan Media, 2008, ISBN 81-87224-25-8, S. 145.